2024.04.04
米国の DCIS 患者の多くは、将来に浸潤性乳がんまたは転移性がんを発症する可能性と、これらの望ましくない結果を回避するためにどうしたらいいのか、化学治療やホルモン剤をするかどうか、選択肢について混乱しているという報告があります。
DCIS の治療目標を明確にします。
第一には その後に発生する浸潤がんを予防することです。
第二の目標は、対側がん、遠隔再発、乳がんによる死亡を予防することです。
切除による治療後に 乳房内で浸潤性のがんが再発するリスクは、DCIS後と 浸潤性乳がん後で差がありません。
ウィメンズ カレッジ病院のデータベースでは、DCIS 後の 15 年間の浸潤性局所再発リスクは 15.6% でした。ステージ 1 の浸潤性乳がんの後では 15.3%、ステージ 2 の浸潤性乳がんの後では 15.9% でした。
患側の浸潤性乳がん発生のリスクを下げるための放射線療法のメリットも、 DCIS 患者とステージ 1 または 2 の乳がん患者で同様でした。Banting データベースでは、患側の浸潤性乳がん再発の 15 年リスクは、放射線療法を受けた DCIS 患者では 14%、放射線療法を受けなかった DCIS 患者では 29% であり、その差は 15% でした。対側に浸潤性乳がんが発生するリスクは、DCIS 後も浸潤乳がん後も同じです。
これらの研究と NSABP 試験から、乳房切除術と放射線療法によって、 DCIS と浸潤がん、両方の局所再発を全く同様に予防するが、乳がんによる死亡は予防できないことを学びました。
乳房切除術、放射線療法、または両側乳房切除術の最終的な利益は、DCIS の女性にとっても、早期浸潤がんの女性にとっても同じであると思われます。では、局所的な治療は同じであるのが合理的ではないでしょうか?
目標1 その後に発生する浸潤がんを予防する それは患側の再発、対側のがんの発生を含みます。
まず患側の浸潤がん(ここではDCISとは異なり、転移する能力を有するがんという意味です)も、対側のがんも、DCIS患者さん、Stage Iの浸潤がん患者さん、そしてStage IIの浸潤がん患者さんで差がないことを示しました。
目標2 対側がん、遠隔再発、乳がんによる死亡を予防する
たしかに全摘する、放射線治療をすることで、患側局所の再発は予防できます。しかしそれはDCIS患者さん、Stage Iの浸潤がん患者さん、そしてStage IIの浸潤がん患者さんで差がありません。そして全摘をしても、放射線治療を付加しても、つまり局所治療を徹底しても、乳がんによる死亡は抑制できませんでした。
それならば Stage 0のDCIS、Stage Iの浸潤がん、Stage IIの浸潤がんで治療方針が異なることはおかしいといえます。少なくともここで示した局所に対しての治療(手術、放射線治療)の方針は同じであるべきです。
DCIS 後の乳がんによる死亡を減らしたい場合は、DCIS 発生時、または局所浸潤性再発時のいずれかに全身療法を施すことを検討する必要があります。タモキシフェンには生存上の利点があるかもしれませんが、私の知る限り、DCISに対するタモキシフェンの死亡率の抑制効果は現在証明されていません。タモキシフェンはがんの発生そのもののリスクを軽減しますが、がん死亡率に対する効果はまだ確認されていないのです。
DCISによる死亡の平均リスクは0ではありませんが大変低いものです。実際には3から6%とされます。それを予防するために全身療法、特に抗がん剤による治療を付加しても、メリットを受ける人はどう見積もってもDCIS患者さんの20人に1人に過ぎず、化学治療ですべての再発が防げるものではありませんから、その数字はさらに低いものになります。副作用が強い抗がん剤使用を正当化するには低すぎます。
しかし将来の死亡のリスクがはるかに高い(たとえば12%)DCIS患者のサブグループを特定できたらどうなるでしょうか? そうすれば化学療法は正当化されるだろうと主張する人もいるかもしれません。
Mannu Dr.らは、検診発見されたのではないDCIS症例は、検診で発見されたDCIS症例よりも死亡リスクが驚くほど高いことを指摘しました。(検診発見された DCIS の女性の20年後における死亡率は4.4%、それ以外の方法で発見された DCIS の女性では 6.1%)
Mannu GS, Wang Z, Dodwell D, 他:英国における1990年から2018年までの浸潤性乳がんと非スクリーニング検出後の上皮内乳管がんによる乳がんによる死亡:人口ベースのコホート研究. BMJ 384: e075498, 2024.
死亡率が上昇する危険因子には、それ以外にも、診断時の年齢が若いこと、黒人人種、病巣が多いこと、微小浸潤、腫瘍サイズ > 25 mm などがありました。
若い黒人女性の間で、DCIS により死亡するリスクは 10% に近づきます。 Mannu らの研究では、45 歳未満で診断された患者の 25 年間の乳がん死亡リスクは 7.6% でした。
筆者から
このコラムでスティーブン・A・ナロッド医学博士は、「私は、まだ DCIS から「がん」という言葉を取り除くべきではないと思います」と結論付けています。
私自身は DCISの患者さんで局所再発は何例も経験していますが、それによる死亡例はほとんど経験していません。
温存にせよ、全摘にせよ、術後の乳房や皮膚に再発病変が発見された時、それがDCISであることはほとんどなく、ほぼ浸潤がんの形式をとっています。それがいわゆる最初の治療の”取り残し”なのか、それとも新しく発生したがんなのかは確定する方法がないため、いつも悩みの種でした。今回 Mannu先生の論文は20年の経過観察からですから、10年以上たって術後の乳房にがんが出てきても再発とは考えない先生も多いでしょう。
ただそういった局所再発が発生する確率がDCISでも浸潤がんでも差がないのだとしたら、少なくとも浸潤がんで建てられる治療方針と DCISでの治療方針で差が有ってはいけないでしょう。浸潤がんを温存切除したら放射線治療を加えるのなら、DCISもそうするべきです。大きな浸潤がんは温存切除の対象にならないなら、大きなDCISも全摘するべきです。
DCISの手術後に、浸潤がんとして再発すれば、浸潤がんとして必要なホルモン剤、抗がん剤など、全身治療を加えるべきです。ただ他臓器への遠隔転移として再発すれば、もはや治癒は望めません。私自身はDCISから、浸潤がんでの局所再発を経ることなく、いきなり遠隔転移をきたした患者さんの経験はありません。ただMannu先生によれば、DCIS治療後の死亡例は意外にも多いことが示されています。当然、DCIS後に局所再発を経たにせよ、経ていないにせよ、最終的には遠隔転移をきたし、亡くなったということになります。
DCIS後に、補助的に全身治療をすることは賛成できません。
しかしもし局所に浸潤がんで再発をきたした場合は、DCISの経過は関係なく、浸潤がん、それも警戒をようするものとして治療は全力を尽くすべきと言えると思います。やはりがんはがんだ、という考え方に賛成します。
2024.04.04
上皮内乳管がん(DCIS)の女性を手術または放射線療法で治療する必要性についてはまだまだ多くの議論があります。上皮内がんは以前にお話しした乳管内乳頭腫と同じで、病変が粘膜内にとどまっており、他臓器に転移しません。したがって理論上はその診断が正しい限り切除してしまえば根治します。
わざわざおいておく必要もない、切っておけば安心だ。
私もそう考えていました。ただ乳管内乳頭腫のところでも触れましたが、乳管内乳頭腫の97%はそのまま安定しており、しかもその1/4は自然消滅してしまう、となると考え方は揺らぎます。
もちろん病理学にのっとり、病理のDrが診断する限り、乳管内乳頭腫は”良性”であり、DCISは”悪性”です。がん、悪性とはどういうことか。がんの定義は”無限に増殖する細胞によって構成された腫瘍”です。けっして”転移する”、放置していれば”命を奪う”腫瘍、と定義されているものではありません。増殖する、だけです。
一生かけて 1mmが2mmに増殖しつづけても(証明できないでしょうが)がんということになります。そのまま気づかずに一生を終えるでしょうが、それでもがんはがんです。
DCIS 患者が早期浸潤性乳がんの女性と同じように治療されていることは、多くの人を当惑させています。 より早期、Stage Iではなく、Stage 0なのに治療方針に現状差がない。DCIS 患者の多くは両側乳房切除術を受けています。
逆に差をつけようとして、術前にDCISと診断されていても、たとえばセンチネルリンパ節生検を施行し、切除標本で断端を標本全体にわたって観察し、 手術や放射線療法を避け得る可能性がある、リスクが十分に低い女性を特定するために多大な努力が費やされています。
Mannu Dr.らは、英国におけるDCISの女性の、最近の乳がん死亡率を追跡調査しました。そして術後20 年時点での死亡率が驚くほど高いことを発見しました。
検診発見された DCIS の女性の20年後における死亡率は4.4%、それ以外の方法で発見された DCIS の女性では 6.1% でした。
そしてその乳がん死亡率は外科的アプローチ(つまり全摘か、温存なのか)によってほとんど変わりませんでした。乳房切除術で治療された患者は、たしかに浸潤性再発がはるかに少ないという結果が出ましたが、乳房切除術で治療された患者と同様の死亡率を示しました。
スクリーニングで検出されなかったDCISの女性22,753人のうち、25年間の乳がん死亡率は、乳房切除術で6.5%、乳房切除術と放射線治療で8.6%、放射線治療なしの乳房切除術で7.8%でした。
上皮内乳がん (DCIS Stage 0)の患者さんであっても、20年間観察すれば4~6%の確率で亡くなっていることは驚きです。
それは手術で取り残しがあったということを考えなければ、DCIS全体で4~6%は上皮内癌ではなかった、転移を起こす浸潤癌だった、ということになります。病理学的な過小評価です。
でもだからこそ全摘すべき、切除すべき、とはなりません。というのも乳房全摘する、温存して放射線治療する、温存して放射線治療しない、その3つの選択肢の間で成績に差がなかったのです。治療レベルを上げても成績に差がない、それはどういうことか?
手術や放射線など、切ったところだけ、当てたところだけに影響する治療法を局所治療と言います、逆に抗がん剤や、ホルモン剤など、全身に影響を及ぼす治療を全身治療と言います。局所治療によって差が出ない、それはがんが命をうばうときはほぼすべて転移が関係していることにあります。つまりすでに乳腺から出ているのです。だから局所治療では差が出ない。
DCISの 4~6%は過小評価されており、浸潤がんであり転移能力があります。ただその場合、治療をされた時点ですでに転移は達成されており、局所をどれだけ頑張っても治療成績には差が出ない、そういう意味になるのです。
ではDCISにホルモン剤をする?抗がん剤をする?
このコラムをかいたスティーブン・A・ナロッド医師はそこに触れていきます。
これまでのところ、DCIS 治療研究における私たちの焦点の多くは、放射線療法を回避できる再発リスクが十分に低い患者のサブグループを見つけることです。治療を省略、緩和すること目標に定めることはもちろん素晴らしいですが、それで命が犠牲になる方多いのでは話になります。そういう方が最終的に浸潤がんで死亡するのか、それを特定するためにもっと努力する必要があると思います。
では乳がんによる死亡リスクが 12% 以上である DCIS 患者を最初に特定できた場合、こうした患者さんに化学療法の施行を検討するのは合理的でしょうか?
私を困惑させているのは、そもそも温存切除術を受けた患者の方が、乳房切除術を受けた患者よりもなぜ成績が良くないのかということです。DCIS 患者は通常術後補助化学治療は受けておられません。
もしその後に局所再発が認められた時には補助化学療法をどのくらいの頻度で受けているのでしょうか? DCISの切除後に、局所で浸潤がんで再発があった際には、補助的に化学療法をしておくべきと考えられます。効果的な治療法であると推測されています。
DCIS後の転移再発(それは当然発生した時点で転移能力がある浸潤がんであり、もはや上皮内がんではありません)や浸潤がんとしての局所再発は、救命のためには全身療法を提供する機会を逃してはならず、効果的な治療法であると推測されています。
乳房切除術を受けてDCISで死亡した女性は、通常、最初に局所再発ではなく遠隔再発を起こし、その時点で化学治療が行われています。しかし遠隔転移をきたしてからどんなに抗がん剤治療を頑張ったとしてもそれでは治癒は望めません。
DCISの患者さんが術後に補助的に抗がん剤治療を受けることは現状はない。
DCISの患者さんが、その後に局所再発(切除した皮膚や胸壁にがんが再び現れる)し、それが浸潤がんであった際には、抗がん剤をはじめとした全身治療を施行しておく必要がある。
転移をきたしてからでは治癒は期待できない。
2024.04.03
「乳がんと診断されました。病院に受診して、PETやCTなど様々な検査をして、やっと手術が決まったと思ったらさらに2週間待ちと言われました。診断されてからなら1か月も経っています。大丈夫ですか?PETでは転移はないと言っていただけたのに、この2週間で転移してしまったらと思うと、いてもたってもいられません。」
これはよく受ける相談です。私の施設で可能なのは診断までなので、手術や抗がん剤が必要となれば大きな専門施設へ紹介になります。すると上記のような相談をもって患者さんがよく帰ってこられるのです。
一つには、「では明日切ってあげる」という施設で治療を受けますか?ということがあります。
家を建てるとき、いろいろな工務店やハウスメーカーに相談するでしょう。いろいろプランを立て設計し、着工となれば3か月はみておいてください、と言われた。ところがある工務店に行くと、わかりました、明日から着工します、お金は後から請求します、と言われたらどうですか?警戒するでしょう?
家と一緒にはいかない、それはそうです。命は何より大切ですから。
ただ、だからこそより慎重に、そして準備に関してよりしっかりしておくことが当然なのではないですか?むしろ逆でしょう。
先日も同じ相談を受けました。
ここでそこでその患者さんにした回答を紹介させていただこうと思います。

検査が終われば、治療は1日でも早く始めていただいた方がいい。これはその通りです。
検査で必要な時間と日にちは仕方はないですが、それが終わってしまえば治療方針はたっているのですから早く始めていただいた方がいいに決まっています。
実際 診断から治療開始まで、2週間以上かかると治療成績に差が発生するとした論文もあります。
Zhu S, Li S, Huang J, Fei X, Shen K, Chen X. Time interval between breast cancer diagnosis and surgery is associated with disease outcome. Sci Rep. 2023; 13: 12091.
ただ、5mm以下の早期がんがそれから2週間で進行するのと、2cmを超える乳がんがそれから2週間で進行するのには大きな差があることでわかるように、またがんの進行速度には差があることも知られており、2週間という期間がその患者さんにとってどれくらい重いものなのかは差があります。あくまで一般論として、検査で必要な期間でない限り、治療の待機時間は短ければ短い方がいいのは当然です。
そしてそれが患者さんの不安につながるのも事実です。
それを踏まえて私がした回答です。
参考にしていただければ幸いです。ただ個人を同定できないように実際とは多少変更しています。
******************************************
「お話しを要約すると、現在のAさん(80歳)の乳がんは cT1c(14mm) N0 M0 Stage 1である、つまり早期癌ということになります。
ホルモンレセプター陰性 HER2 陰性でトリプルネガティブ乳がんとされている。乳がんの中では比較的悪性度が高く、注意が必要だと聞いておられる。細胞分裂指数も高いと聞いた。
2週間後の手術予定だが、現在はリンパ節転移がない、早期癌の範囲にとどまっていると言われているのに、その間に転移してしまったら台無しになる。そういう相談ですね。
現在Aさんの乳がんは14mmとされています。これはマンモグラフィー、超音波検査、MRI、どれで測定したかによって少し値が異なると思います。検査時期ではMRIが最後になっていることが多いと思います。MRIはたいていUSより大きく見えるので、MRIでサイズが大きく計算されたとしても、実際にがんが大きくなったとは言えません。
さて乳がんでは腫瘍が10mmに達した時点で癌細胞はすでに10億個存在しているとされます。
癌細胞1個が2個になるのに3ヶ月程度と言われています。
細胞は23回分裂すると10億個になるので1cmになるのに最低でも23×3ヶ月で69ヶ月です。
つまり癌細胞が1個発生してから5年、60か月以上経過していることになります。実際には1cmに達するまでに10年と言われています。
10年の経過からすればこの2週間はあまりに短く、誤差範囲でしょう。
がん細胞は、そのすべてがリンパ節などの他の臓器に転移する能力を持っているのではありません。最初から持っているものもいますが、その多くは分裂して増えているなかで転移する能力を獲得していくと言われています。
がん細胞の数が増えれば増えるほど、転移能力を獲得する個体が出現する確率は増えますので、どの癌もいずれは転移する能力を獲得します。もちろん大きくなればなるほどがん細胞の数も多くなるので確率は増えます。
それでもそれがこの2週間に限定して起こることはまず考えなくてもいいでしょう。
転移しているものなら、検査して、転移はないとされてももう転移していると考えるべきです。もし本当に検査通りに転移していないのならこの2週間で起こる確率はほぼ無視できるほど小さいのです。
図を書いてみました。参考にしてみてください。
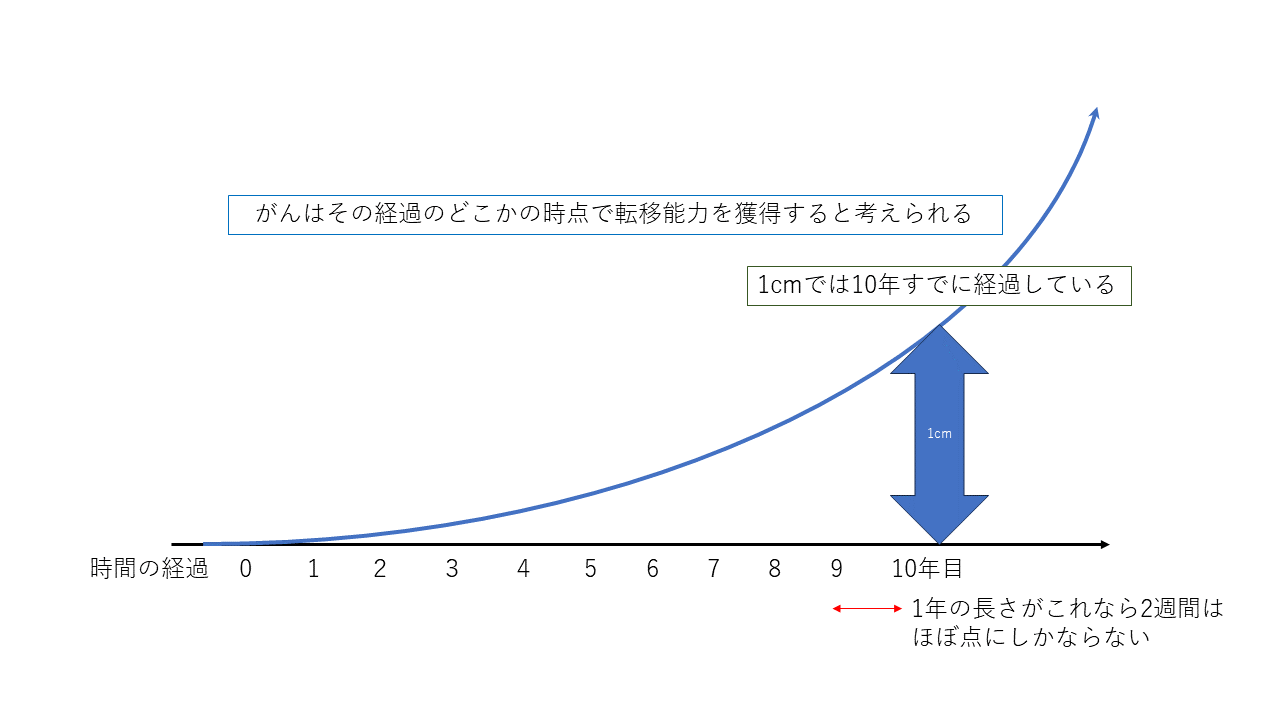
それを考えれば、この2週間を恐れて無理矢理に予定を変更してもらったり、まして病院を変えたりすることはむしろAさんに不利に働くことはあっても有利に働くことなどない、といえるのではないでしょうか?」
トリプルネガティブ乳がんはリスクが高いので抗がん剤が必要となることが多い。でもAさんは高齢なので抗がん剤は難しいと言われてしまった。それならばなおさら手術を急いでほしい。
「わかりました。抗癌剤ですが、年齢を考えれば確かに投与は難しいでしょう。
乳癌は、末期がんと診断されてから、平均4年前後で死に至ることが多いとされます。もちろんAさんは末期がんと診断されていません。現状では早期がんと診断されています。
これからの経過の中でもし再発して末期がんと診断されたらの話です。それはあり得たとしてもまだ先でしょう。乳癌の再発は平均すると3-4年目に多く発生するとされます。そしてそれから4年間は平均生きられると申しているのです。すると最悪のシナリオを考えてもあと7年生きられます。
するとAさんは87歳になられています。日本人の平均寿命は女性で87.74歳です。
再発する最悪のシナリオを考えてもほぼ寿命を全うされています。それを考えればもしかして年齢的にそれで命を落とすかもしれない強力な抗がん剤を強行することは本末転倒です。
手術に先行して抗がん剤を施行することがあるのは知られています。手術の待ち時間が長いなら先に抗がん剤をしてもらう、それは選択肢ではありますが、Aさんの年齢からはリスクはあっても有利とはいえません。
先に手術をし、これ以上は進まないようにしておいて、リンパ節転移の有無を確定させてから、抗がん剤が必要かどうか、それから改めて治療方針を再検討する方が得策でしょう。
こうして考えていくと、主治医は至極まっとうな判断をし、最善の治療を提案されていることになります。説明も別紙を参照させていただく限り省略せずにキチンとされていました。信頼してついて行っていだけるのではないでしょうか?
以上、昨日は整理しきれなかったことを文面でお伝えしました。
また元気でお会いできることを祈念しております。」
ホルモン受容体陽性 (HR陽性)、ヒト上皮成長因子受容体 2 陰性(HER2陰性)、リンパ節転移陽性の乳がん患者さんでは、再発リスクが高く (様々なデータがありますが5 年で最大 30%が見込まれます)、治療の強化、対策が必要とされてきました。
ホルモン剤による内分泌療法と併用して、2年間 術後に補助として アベマシクリブ(ベージニオ🄬)を飲用することは、現在では HR陽性HER2陰性、そして再発リスクが高いリンパ節転移陽性の患者に対する国際的に承認された標準治療になっています。
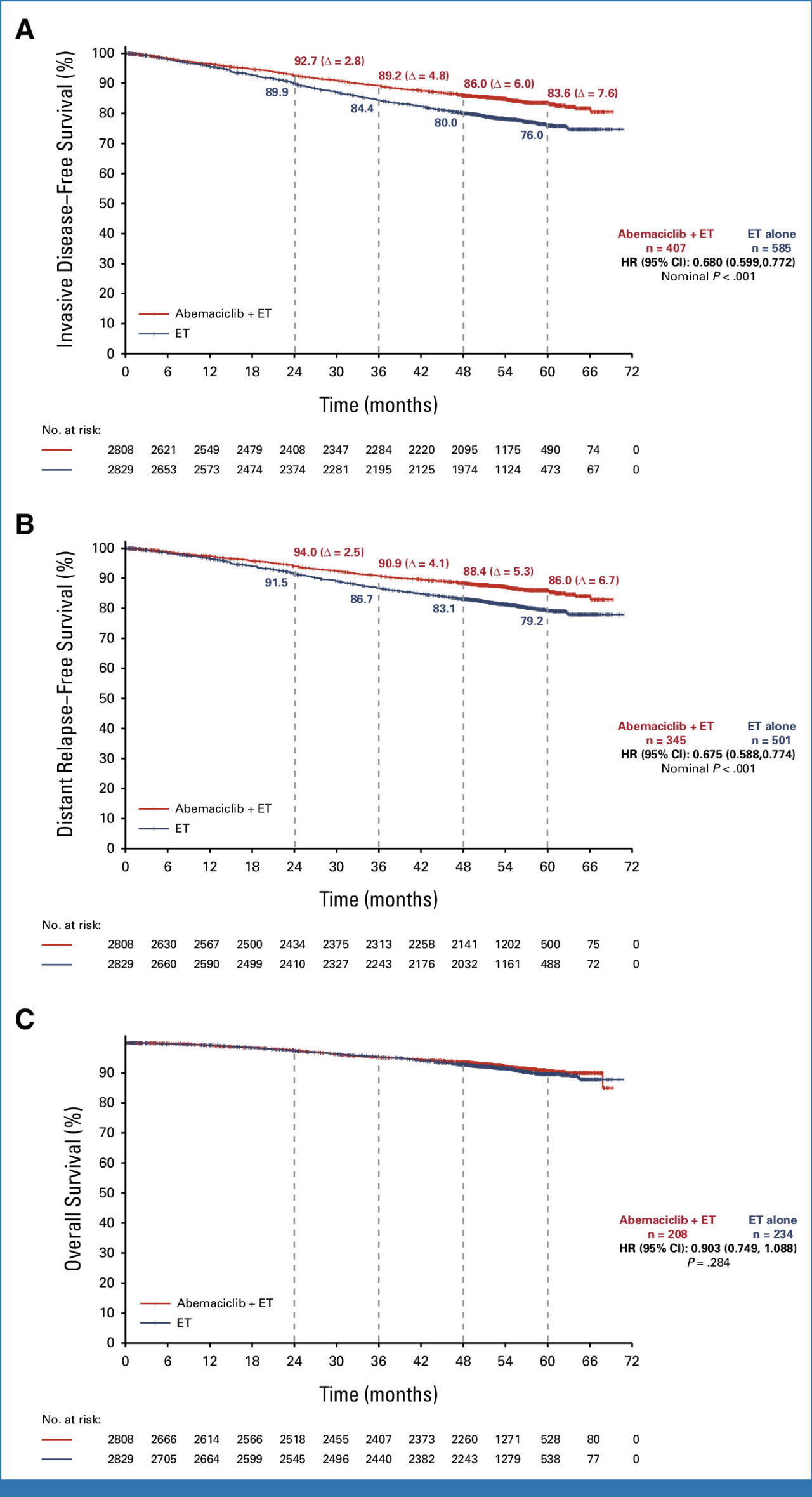
アベマシクリブは追跡期間中央値42カ月(4年弱)で、全患者が治療を終了した時点の2年間の治療を超えて、無浸潤病生存期間(IDFS)*および無遠隔再発生存期間(DRFS)の持続的な改善を示しました。
*無浸潤疾患生存期間とは、手術日から浸潤性病変の再発と判断された時点、またはあらゆる原 因による死亡日までの期間です。浸潤性病変とは、病理学的に、他臓器に転移を起こす能力があると判断される病変の総称です。つまりその病変の切除を行っても完治しない可能性が示唆される病変です。
全生存期間(OS)は未だ結論が出ていませんでしたが、今まで通りのホルモン剤による内分泌療法単独群と比較して、アベマシクリブを併用した群での死亡数が少なかったことから、おそらくアベマシクリブ併用群では最終的に生存率でも有利な結果が出ることが予想されていました。
ここでは最新のOSの評価結果を示します。
Rastogi P, O'Shaughnessy J, Martin M, Boyle F, Cortes J, Rugo HS, et al. Adjuvant Abemaciclib Plus Endocrine Therapy for Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative, High-Risk Early Breast Cancer: Results From a Preplanned monarchE Overall Survival Interim Analysis, Including 5-Year Efficacy Ou. Journal of Clinical Oncology. 2024.

ベージニオ🄬は比較的新しい薬剤でジェネリックも存在しないため、大変高価です。会計の時にびっくりされる方も多いと思います。
加えて代表的な副作用は下痢です。下痢とまでいかなくてもたいていは軟便で苦労されておられる方も多いと思います。脱毛や嘔吐が多くみられる抗がん剤とまではいかないまでも副作用のないものではありません。白血球もよく下がってしまいます。
できたら治療が完了した後まで飲みたくない、そう思われている方も多いのではないでしょうか。さらにそれが2年継続しますから大変です。
メリットがわかれば、デメリットの我慢もできる、そう思って紹介しています。
この臨床試験を、monarchE 第 III 相グローバル試験と呼びます。
合計 5,637 人の患者が 2 つの群に割り当てられました。
コホート 1 ( 5,120名)は、少なくとも 4 つの腋窩リンパ節 転移あり、または組織学的に異型度3以上、 あるいは 腫瘍のサイズ が5cm 以上、のいずれかの特徴を伴う再発の高危険群です。
コホート 2 ( 517名)は、1 ~ 3 個のリンパ節転移陽性、あるいは細胞分裂指数 Ki-67 ≧ 20% である患者が含まれていました。
これらのコホート 1 とコホート 2 の集団を
ホルモン剤単独で治療する群と、アベマシクリブを2年間併用してホルモン治療を行う群のふたつにランダムに(1:1)割り当てました。
結果
患者の約80%は少なくとも4年間(治療期間終了後2年)追跡されています。
術後に浸潤性病変の発生のリスクを軽減するというアベマシクリブの継続的な利点が統計学的に証明されました。実際には発生リスクを3割以上減少させました(HR、0.680, 95%CI; 0.599 ~ 0.772, p < .001)。上の図のAです。
術後に遠隔転移の発生のリスクを軽減するというアベマシクリブの継続的な利点もまた統計学的に証明されました。実際には発生リスクを3割以上減少させました(HR、0.675, 95%CI; 0.588 ~ 0.774, p < .001)。上の図のBです。
最終的な生存率では差が出ることがまだ証明されていませんが、時間の経過とともにそれも明らかになるでしょう。上の図のCです。
まとめ
アベマシクリブ(ベージニオ🄬)は、確かに高価で、2年間と長く、副作用も様々あるけれども、遠隔再発率を3割以上下げるなど、それに見合った効果があり、再発が予想される高リスクホルモンレセプター陽性HER2陰性乳がん患者さんには投与が強く勧められる、と言えるでしょう。
2024.03.08
がんは進行すると転移をします。そしてその多くはリンパの流れに乗って、所属リンパ節と呼ばれるその臓器に最も近いリンパ節に最初に転移します。乳がんの場合はそれは腋窩(わきの下)のリンパ節になります。乳腺と一緒に切除されたとしてもリンパ節はリンパ節であり、乳腺とは異なる臓器です。
腋窩リンパ節に転移があれば、それは「この乳がんは転移する能力がある」ということになります。がんは「無限に増殖する細胞で構成された腫瘍」とは定義されますが、転移するかどうかはそのがんによります。とはいえ進行すればたいていの乳がんは転移をきたします。
骨、肝臓、肺など様々な臓器に転移しますが、それら臓器をすべて切除して調べるわけには行けません。そこでまずPETやMRI、CTなどの機械を駆使して手術前に転移があるかどうか調べます。ただこれらの機器では小さな転移巣は捕まえられません。今でも胃カメラや大腸内視鏡を行うのはなぜか。これらの機械では早期がんをほぼ発見できないからです。臓器や機械によりますが小さな病変を見つけるのは原則苦手なのです。
そこで乳がんの手術の際には、乳腺を切除するのと同時に腋窩のリンパ節を郭清といって根こそぎすべて取って、転移があるかどうか調べる、ということが行われてきました。
前述しましたが、腋窩の所属リンパ節に転移があれば、このがん細胞は転移をする能力がある、ということになります。それはすなわち検査で捕まらなくても肺や肝臓などどこかに転移したがん細胞が潜んでいる可能性が高い。だから手術が終わったら念のため、全身に向けて抗がん剤を投与しておく、という治療方針を立てるのに役立ちます。
転移があるリンパ節は切除する必要があります。それは治療です。ただ腋窩のリンパ節を切除することには検査の意味も含まれていたのです。
ただ早期がんの患者さんまですべての方に、腋窩のリンパ節を、しかも全部取って調べる必要があるだろうか、とはだれでも考えるでしょう。手術前に超音波検査や、PET、MRIなどでどう見ても転移はなさそうに見える早期がんの患者さんに、腋窩のリンパ節を根こそぎとってまで調べる必要があるようにはおもえません。しかも腋窩のリンパ節を根こそぎとってしまうと、リンパ浮腫という合併症を覚悟しないといけなくなります。
そこで考え出されたのが、センチネルリンパ節生検という手法です。詳細は省きますが、乳がんに特殊なインクを注射し、それを追いかけ、最初にそれが流れ着いたリンパ節を採取して調べる、そこに転移がなければそれ以上の腋窩の郭清は避ける、という考え方です。
センチネルリンパ節生検 (SLNB) は、早期乳がん患者における腋窩リンパ節転移の有無を調べ、病期(ステージ)を正確に診断することができる、とすでに証明されており、いまでは標準の手術方法になっています。この技術は数個のリンパ節を採取して調べるだけで、腋窩リンパ節を根こそぎとって調べることと同じ結果をもたらします。この技術はがんの外科治療をできるだけ縮小し、侵襲を小さくできる画期的な発明でした。
さらに米国外科学会腫瘍学グループ Z0011 (ACOSOG Z0011) のランダム化臨床試験の結果から、たとえセンチネルリンパ節生検の技術を用いた結果、センチネルリンパ節転移が陽性であっても、それが2個までであれば腋窩郭清をする必要はなく、腋窩郭清をしてもしなくても生命予後に違いがないことが明らかになっています。よほど大量に転移をしていないかぎりは腋窩のリンパ節を根こそぎとるような手術をしても意味はないのだから、術前にはっきりした転移が画像上指摘できないような患者さんにはセンチネルリンパ節生検をしておくだけで十分だ、とわかります。

画像上にはっきりしたリンパ節転移が腋窩に認められないような早期がんの患者さんはセンチネルリンパ節生検をしておくことで腋窩郭清を省略していい。たいていは本当に転移はなく、またあっても2個までなら抗がん剤はしたとしても手術でそれ以上根こそぎとってしまうことに意義はない。
だとしたらどうでしょう、早期がんで、画像上も腋窩のリンパ節転移がなさそうな患者さんには、そもそもセンチネルリンパ節生検そのものもしなくてもいいんじゃないのだろうか、そうなるのも当然です。
今回この疑問に対する大規模ランダム化臨床試験が行われ、結果が出ました。SOUND (Sentinel Node vs Observation After Axillary Ultra-Sound) 試験は、イタリア、スイス、スペイン、チリで実施された前向き非劣性第 3 相ランダム化臨床試験です。2012年2月6日から2017年6月30日までに、乳がんが2cm以下で術前の腋窩超音波検査で腋窩リンパ節転移陰性と診断された、任意の年齢の女性計1,463人が登録されました。これらの症例はSLNB を受ける (SLNB 群) か、腋窩手術を受けない (腋窩手術なし群) に 1:1 の比率で無作為に割り付けられました。
Gentilini OD, Botteri E, Sangalli C, Galimberti V, Porpiglia M, Agresti R, et al. Sentinel Lymph Node Biopsy vs No Axillary Surgery in Patients With Small Breast Cancer and Negative Results on Ultrasonography of Axillary Lymph Nodes. JAMA Oncology. 2023; 9: 1557.
結果
5年間 遠隔転移無しで生存できる確率はSLNB群で97.7%、腋窩手術なし群では98.0%でした。
SLNBを省略しても、治療成績に影響がないことが証明されました。 (ハザード比、0.84、90% CI、0.45-1.54、非劣性P = 0.02)。
5年間再発無し生存期間は、SLNB群では94.7%、腋窩手術なし群では93.9%でした。
5年間生存率は、SLNB群で98.2%、腋窩手術なし群で98.4%でした。
これも差がありません。
遠隔転移の5年間累積発生率は、SLNB群で2.3%、腋窩手術なし群で1.9%でした。
腋窩再発の5年間の累積発生率は、両グループとも0.4%でした。
これも差がありませんでした。
ぜひ論文も参照していただければと思いますが、グラフで見ても驚くほど差がありません。
苦労してセンチネルリンパ節を探し出して生検しなくても結果は変わらないとわかりました。
今後実際に臨床で試され、結論が浸透していくのでしょうが、センチネルリンパ節生検そのものも必要な症例は限定されることになるでしょう。早期発見されれば乳腺のその腫瘍の部分だけを切除して終わり、そうなれば患者さんもずいぶん楽になります。ただ大前提が早期発見されていること、ですからそこは注意が必要です。どこまでいっても早期発見に勝るものはない、ということでしょう。
2023.07.27
乳癌の術後に、タモキシフェンや、アロマターゼ阻害剤といった飲み薬を飲まれている方は多いと思います。ホルモン感受性陽性と呼ばれる乳がん細胞は、女性ホルモン(エストロゲン)を抑制すると、増殖もそれに反応して抑制されるため、これを目的として処方がなされます。
ただこれと一緒に、ゾラデックス🄬、リュープリン🄬といった卵巣機能抑制のためのお薬を注射で併用されている方も多いと思います。注射なので痛みもあり、また値段も高価であることから必要性に関して疑問を感じておられる方も少なくないでしょう。
なぜ2種類も薬を使うのか?タモキシフェンだけではだめなのか?
これは正直、簡単に説明をすることが難しく、何度かこのブログでも説明をしてきました。よければこの内容も理解されたうえで、今回の記事を読んでいただければ幸いです。
ランダム化試験のメタアナリシス、と呼ばれる研究手法があります。
お薬が開発されたり、新しい投与方法が感がられた際に、それが本当に有効なのか、を調査することは大変な困難が伴います。たとえば皆さんの関心の高い”認知症”ですが、ある薬が開発され、これが効果があるか調査したいとなったとします。もちろん効果だけではいけません。副作用もその内容によっては効果を上回ることもあるでしょうから、合わせて調査が必要です。
その薬を飲まれた1000人の認知症の患者さん、飲まれなかった1000人の患者さんを比較することは最低限必要です。
ただこの際に飲まれた患者さんは、その製薬会社の指名した病院で手厚い介護をされ、リハビリもされていた、飲まれていない患者さんはそのままとされた、としたらどうでしょうか。結果はおそらく影響されるでしょう。
こうしたことを防ぐために様々な工夫をして、初めて信頼性のたかい結果が得られます。
ホルモン感受性の、閉経前の女性における乳がんの再発予防において、卵巣切除または抑制が有益であることが今回の研究でも確かめられました。
この調査結果は、数十年にわたる約15,000人の女性を対象とした研究に基づいており、2023年のASCO年次総会で英国オックスフォード大学名誉教授のリチャード・G・グレイ修士、修士によって発表されました。グレイ博士は、早期乳がん臨床試験協力グループ (EBCTCG) を代表してこの研究を発表しました。


「エストロゲン受容体陽性腫瘍を患う閉経前の女性にとって、卵巣抑制と卵巣切除には実質的かつ持続的な利益がある」とグレイ博士は報告しました。「以前に化学療法を受けており、化学療法後も閉経前のままである女性にも、化学療法を受けなかった女性と同様の効果が見られました。」
今回の検討の一つのポイントですが、乳がんの治療はホルモン剤を使用している方も、同時に抗がん剤をうけておられる場合があります。閉経前女性であっても、抗がん剤治療をうけると、その毒性によって卵巣機能が破壊されてしまって、医原性に閉経してしまうことがあるため、こうした女性ではあえて薬剤を付加してまで卵巣抑制を行う必要は本来ないはずです。その点に注目して今回の検討は行われています。
化学療法を受けていない女性、または化学療法後に閉経しなかった女性 (n = 7,213)の検討では
15 年時点での再発率は対照群で 39.3%、卵巣切除または抑制群では 29.5% で、絶対利益は 9.8%であった。(RR 0.71: P < 0.00001)。
化学療法前は閉経前だが、化学療法後の閉経状態が不確かな女性(n = 7,786)の検討では
15 年時点での再発率は対照群で 44.4%、卵巣切除または卵巣抑制群では 43.1% で、絶対利益は 1.3%であった(RR = 0.91; P = 0.02)。
化学療法を受けていない患者、または化学療法を受けても閉経しなかった患者では、その利益は時間の経過とともに大きくなり、絶対差で見た際に5年で約6%、10年で8%、15年で10%に増加しました。
一方、残りの半数の患者(つまり閉経してしまった患者で)の違いは「ほとんど識別できなかった」とグレイ博士は述べた。研究は数十年に及んだが、研究結果には一貫性があり、試験間に大きな異質性はなかったと同氏は付け加えました。

年齢の影響は、化学療法を受けていない患者集団で最もよく観察されます。これは化学治療によって卵巣機能が抑制、あるいは破壊されることを考えれば当たり前ですが、今回の検討では年齢は利益に明確な影響を及ぼさなかったようです。
45歳未満(n = 4,437)の患者さんでは
15年間の再発率は対照群で41.3%、卵巣切除または卵巣抑制群では30.4%で、絶対利益差は10.9%であった(RR 0.66: P < 0.00001)。
45~54歳(n = 2,776)の患者さんでは
15年間の再発率は対照群で36.1%、卵巣切除または抑制群では28.6%で、絶対利益差は7.5%であった(RR 0.82: P < 0.02)。
グレイ博士は年齢に応じた分析について説明し、まず化学療法を受けた集団のデータを提示した。同氏は、閉経前の「高齢」患者のほとんどは化学療法により無月経になると指摘しました。したがって、追加の卵巣切除や抑制は彼らにとって何の利益ももたらしません。若い閉経前の患者の約 50% も無月経になります。メタ分析の結果はこれを反映しており、39 歳未満の女性では「わずかな利点」(RR ≈ 0.80)があり、それ以上の女性では実質的な利点がないことが示されました。同氏は、このグループの試験は閉経前女性の卵巣切除を真に試験していないとして「却下」されるべきだと述べました。
(これはわかりにくいですが、解説します。いままで40歳以上の閉経前女性が、化学治療を受けていた場合、過去の試験結果がどうであれ、それは薬によって閉経している影響を除外できないので、採用できない、つまり、卵巣機能を抑制する意味は証明されていない、と述べています。)
化学療法を受けていない患者、または治療後に閉経しなかった患者では、卵巣の切除または抑制は乳がん関連死亡率および全死因死亡率の大幅な減少と関連していました。
20年時点での絶対利益差は、乳がん関連死亡率で10.9%(RR = 0.71; P < 0.00001)、全死因死亡率で11.6%(RR = 0.75; P < 0.00001)でした。(つまり乳がんによる死亡を20年間で10%も抑制する)
「これは乳がんによる死亡率の減少において非常に目覚ましい成果であり、非常に重要です。そして、これらの試験の多くで非常に長期にわたる追跡調査が行われ、その利点が少なくとも 20 年間持続することがわかります」とグレイ博士はコメントしました。
リンパ節転移陰性疾患の女性 (RR = 0.70; P < 0.00001) とリンパ節転移陽性疾患の女性 (RR = 0.72; P = 0.00005)はどちらであっても、ほぼ同じような利益が見られました。しかし、当然のことながら、リンパ節転移陽性の患者さんでは、もともと15 年再発率が高い(54.5%)ため、したがって卵巣切除または抑制による絶対利益も大きくなりました (11.9%)。
大きな違いをもたらした要因の 1 つはタモキシフェンの使用でした。タモキシフェンの併用がない場合、早期再発リスクは非常に高く、5年で40%を超えましたが、タモキシフェンを投与された患者の5年再発リスクは14%未満でした。「タモキシフェンには大きな利点があることがわかります。再発リスクが最初の 5 年間で 50%、次の 5 年間で 30% 減少します」とグレイ博士は述べました。
そのような状況では、タモキシフェンがすでに保護効果を発揮しているため、卵巣切除または抑制の利益は少なくなるでしょうが、卵巣機能の抑制を自然閉経期である50歳前後まで拡張することには価値があるように見えました。
タモキシフェンを受けていない女性では、卵巣切除または卵巣抑制により15年間の無再発生存率が17.5%向上しました(RR = 0.61; P < .00001)が、タモキシフェンで治療された女性の場合、その向上はわずか4.5%でした(RR = 0.80; P = 0.002)。
筆者注
日本では、タモキシフェンやアロマターゼ阻害剤に加えて、ゾラデックス🄬 リュープリン🄬を使っておられる方が多いと思います。したがって日本では卵巣抑制は多くの場合でタモキシフェンへの”上乗せ”効果で考えなければいけないので、それほど高いものではなくなります。
しかし私は5%程度であっても再発抑制の上乗せ効果があるならばそれはそれで意味があるとは思います。
今回の発表を踏まえて思うのは、化学治療を受けてなお閉経しなかった女性、こうした方はリンパ節転移がある、細胞分裂が盛んだったなど、再発リスクが高い、それで化学治療になっているはずです。それでもなお閉経しなかったのですから、卵巣をしっかり抑制しておいた方がいい、タモキシフェンとゾラデックス🄬、リュープリン🄬の併用がいい、ということは確実に言えそうです。
2023.07.15
乳がんのなかには,病理学的に分類されている、粘液がん,管状がん,腺様(せんよう)囊胞(のうほう)がんと呼ばれる特殊型があります。こうした特殊型の中には通常の乳がんとは予後や薬物療法の適応基準が異なるものがあります。それぞれの病態に応じた治療方針がガイドラインで示されています。
ここでは小葉癌と呼ばれる特殊型乳がんの中では比較的頻度の高い乳がんについて、その管理にどのような違いがあるのか、2023年のマイアミ乳がんカンファレンスで、FASCOのタリ・A・キング医師が、特徴、予後、最適な管理の観点から、より一般的な乳管がんとの違いについて説明してくれています。
キング博士は、ダナ・ファーバー/ブリガムがんセンターの集学的腫瘍学の副議長および乳房外科部長であり、ハーバード大学医学部の女性がん分野の外科学の教授でもあります(日本で言えば東大医学部の教授であり、東大附属病院の部長もしておられるような方、凄い…。でも今回は皆さんにもわかりやすいように不肖私が少し説明を足しながら触れていきます。)。
小葉癌は接着タンパク質とよばれる細胞同士をくっつける働きをするE・カドヘリンという物質を持っていないことが特徴です。
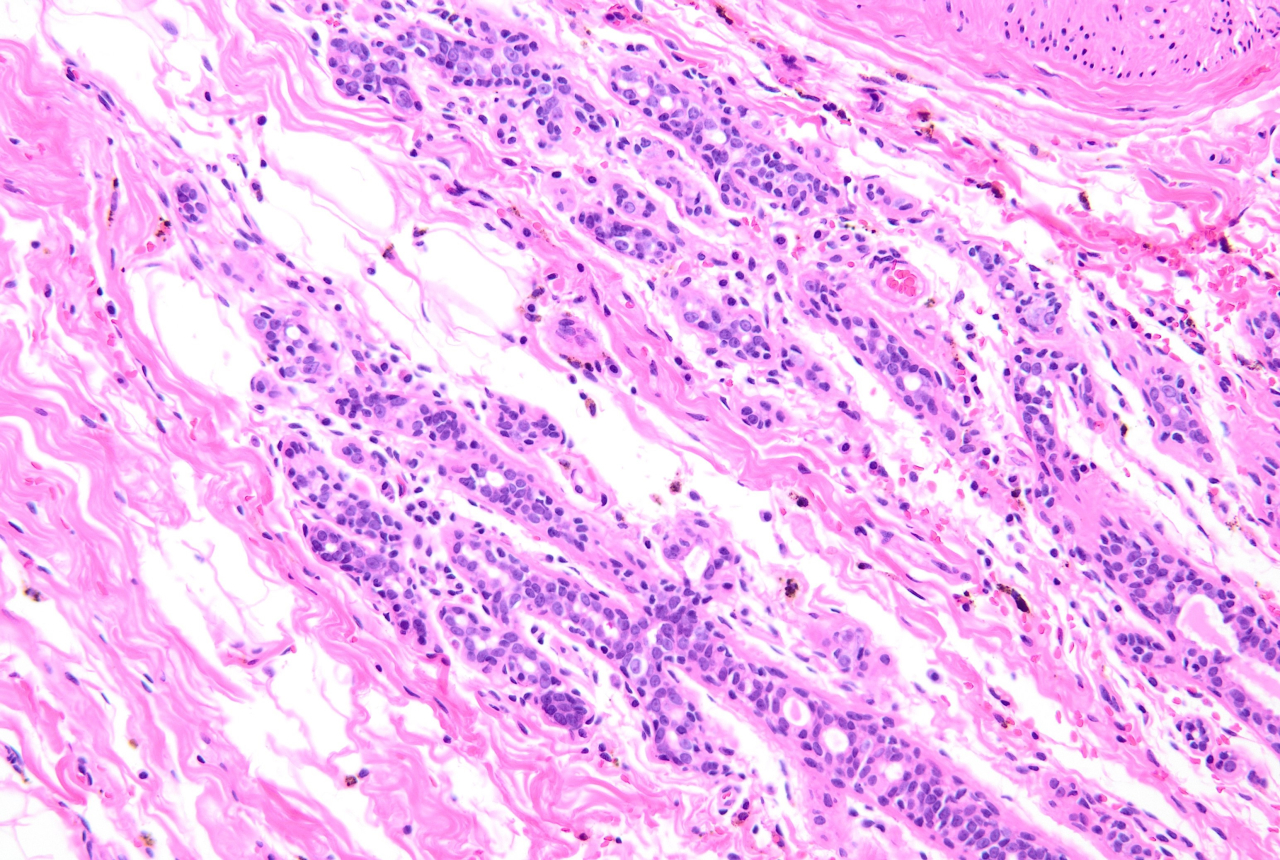
古くから理解されている浸潤性小葉がんは、顕微鏡で見たときに小さな丸い核を持つ単形細胞を特徴とします。そして、細胞間の接着因子であるE・カドヘリンを持たないことから推察できるように、しっかりした構造を構築せず、乳房を通してびまん性に広がる浸潤性の成長パターンをとります。(対して乳管癌は、E・カドヘリン陽性でそのタンパクを発言しており、その名前の通り、乳管構造を取りながら発育します。”浸潤性が高い”、ことは しみこみやすい、ということと同じです。つまり小さながんであっても転移しやすいのではないか、広がりやすいのではないか、と考えられたのです。)
1970 年代から 1980 年代にかけて、小葉がんという乳がんが存在し、その組織学的な特徴がよりよく認識されるようになると、当時の外科医は小葉がんを乳管がんとは別に治療すべきかどうかを疑問視し始めました。この悪性腫瘍をより深く理解するために、過去にさかのぼっての研究が行われましたが、最初の前向き研究は 2008 年まで発表されませんでした。(過去の小葉癌を見直してみて、どのように治療し、どういう経過をたどったか、を調べてみたということ。小葉癌であることを意識して治療しているわけではない。前向き研究では小葉癌を認識したうえで治療を行ってどうだったか、を調べるものになるので、内容的には異なる結果になる)。
組織学的サブタイプの比較
国際乳がん研究グループ (IBCSG)によって、中央病理検査が組織され、そこで組織像が記録された 13,000 人を超える患者を対象とした 15 件の試験の結果が得られています。それをまとめました。
IBCSG は、小葉がんは乳管がんと比較して、より高齢者に多い、より大きな腫瘍で発見されることが多い、および乳房全摘で対応されることがより多い、ことを発見しました。これは過去の症例の検討からすでに指摘されていました。
新たな発見もありました:乳管がんであるか、小葉がんであるか、はその初期にはあまり差がないものの、時間経過に伴って差が出てきます。具体的には再発無しで生存されている割合(PFS)、そして全生存割合(OS)ともに差が出ます。小葉がん患者のPFSは術後6年まで、乳管がん患者よりも著しく低いです。10年のOSで見たとき、小葉がんは乳管がんに有意に劣っていました。(小葉がん患者さんは乳管がん患者さんと比較して、術後6年間は再発しやすい傾向があります。さらに10年後に見たとき、亡くなってしまわれる方も小葉がんの方の方が確率が高いことがわかっています。つまりやはり予後は悪いのです。)
また、ほとんどの小葉がんはエストロゲン受容体陽性であり、そのような患者ではあまり術後早期には再発せず、何年もたってからの晩期再発がより一般的であることが知られています。しかし小葉がんではそれがそうではありませんでした。
「曲線の形状は、エストロゲン受容体陽性患者とエストロゲン受容体陰性患者で類似しており、予後に対する時間依存的な影響がエストロゲン受容体の状態とは無関係であることを示唆しています」とキング博士は述べました。(これはつまりホルモン受容体陽性の小葉がんと、稀ではありますが、陰性の小葉がんで予後が変わらない、ということを意味します。乳管がんではこれは全く異なります。術後早期の再発は圧倒的にホルモン受容体陰性乳がんで多い傾向があります。)
また、局所再発率(温存ならば残された乳腺、切除後の皮膚や腋窩のリンパ節での再発)は小葉がんと乳管がんで同様でした。しかし頻度で見たとき乳管がん患者では局所再発>遠隔転移です。小葉がん患者では局所再発<遠隔再発です。ゆえに局所再発率が同じであるならば、遠隔転移は小葉癌で明らかに多いということになります。乳がんが遠隔転移する場合、乳管がんは骨に広がる傾向があったのに対し、小葉がんは腹膜、卵巣、消化管に広がる傾向がありました。小葉がんでは肺への再発はあまり一般的ではありませんでした。
小葉がんは乳管がんと比較して、
1 高齢者に多い
2 大きな腫瘍で発見されることが多い
3 乳房全摘で対応されることがより多い
4 術後6年間は乳管がんよりも再発しやすい
5 10年後に見たとき、亡くなってしまわれる方も小葉がんの方の方が確率が高い
6 ホルモン感受性の有無によって予後があまり変わらない
7 乳管がんが骨に転移しやすいのに対して小葉がんでは腹膜、卵巣、消化管に転移しやすい。
乳がんの発症リスクに関しても異なる可能性がある
小葉がんの危険因子も、乳管がんに関連する危険因子とは異なる可能性があります。
ホルモン曝露に関する25件の観察研究のメタアナリシスでは、小葉がんと乳管がんについて、ホルモン補充療法、初潮年齢、閉経年齢とのより強い関連性が見られました。
ホルモン補充療法を以前または現在使用している人の中で、小葉がんの相対リスクは 2.0 であったのに対し、乳管がんの相対リスクは 1.5 でした。いくつかの個別の研究では、小葉がんに関連するリスクが 3 倍増加することが判明しました。(つまり女性ホルモンへの暴露とより強い関係があります)
小葉がんの最も強い危険因子は、上皮内小葉がん(LCIS)と以前の診断されたことがある、です。
上皮内小葉がん(LCIS)は浸潤性小葉癌と同じ細胞学的特徴を共有しますが、細胞は末端管小葉単位に限定されています。サーベイランス、疫学、および最終結果のデータによると、上皮内小葉がんの診断後のその後の乳がんのリスクは、10 年で 11%、20 年で 20%、つまり年間約 1% です。上皮内小葉がんは乳管がんと小葉がんの両方の危険因子ですが、このグループでは小葉がんが圧倒的に多く、その後発生するがんの約 30% が純粋な小葉がん、または乳管がんと小葉がんの混合です。
(筆者注: 乳管がんが周囲の組織に診断せず、乳管内にとどまっている場合は、非浸潤性乳管がん(DCIS)と呼ばれます。転移をしないという特徴があり、切除で完全に根治せしめることが可能なので、ステージも0とされます。いわば”前がん状態”ともいえる状態と思います。
同じく小葉がんにも浸潤性と非浸潤性の分類があり、DCISに対してLCISと呼ばれます。当然転移せず、ステージも0扱いです。
たとえば温存切除後に、DCISと診断された場合は、断端陰性でとり切れていることが必須であるとされ、残存乳房へ放射線治療も施行されます。対してLCISは断端の追求は厳密ではなく、放射線治療も施行せず、経過観察とされる傾向が強いです。臨床的には扱いに差があります。
この論文では、しかしそうして放置されている乳腺には後に年間1%で乳がんが発生しますよ、と注意しているわけです。)
これも続きます・・・(最近長いものが多くてすいません)
2023.05.10
久しぶりの更新になり、恥ずかしいです。この3月は検診クーポンを使おうとたくさんの方が来られます。ただなぜか今年はこの時期に、乳腺炎になられた授乳をされているお母さんがたくさん来られました。ミルクの流れがすこし悪くてしこりになることはよくあることですが、細菌感染をともなって真っ赤に腫れあがったりすると、熱も出て、なにより痛みがひどく、どうにもなりません。あわてて当院に駆け込んで来られる方がおられるのですが、ここですこし注意してほしいことがあるのです。
順序だてて説明していきます。
▪️原因と病態
化膿性乳腺炎は、通常、授乳期の女性に見られる乳腺炎の一種で、細菌感染によって引き起こされます。原因は確定していませんが、乳腺で作られたミルクを乳頭に運ぶ乳管に微小な傷がある場合(下図参照)、その部分でつまりが生じてミルクの通りが悪くなります。
通りが悪くなった部位では自浄作用が働かないため、乳管内に貯留したミルクに細菌感染が波及し、そのことでなおさらにミルクの通りが悪くなり、化膿性乳腺炎として認識されるようになります。
乳管に生じる傷ですが、必ずしも乳児にかまれたりして発生するのではなく、もともと何らかの理由で乳管の内腔を覆う粘膜に傷がついて角質化をきたしていた部分が存在しており、細菌感染の培地になりやすい状況が生まれていた可能性が高いと考えられます。
乳腺は発生学的には汗腺と同じものであり、ニキビがそうであるように、細菌感染はこれといった理由なく発生します。授乳期に発症するのは分泌が盛んになってたまりが生じ、細菌が増殖する余地が大きくなることが原因と考えられます。
いったん細菌感染がコントロールできなくなれば、乳腺の組織が炎症を起こして、痛み、発熱、乳房の赤みや腫れなどの症状を引き起こします。授乳中の母親にとって、この状態は非常につらいものであり、授乳を続けることができない場合もあります。そうであってももちろん命にかかわるようなことはありません。しかし、治療が遅れると、さらに乳感染が周辺に波及することで組織が破壊され、さらに細菌の巣となり、将来の発生母地になります。
また大きな膿のたまり、つまり膿瘍が形成され、最終的には皮膚に穿破して瘻管の形成などの合併症が発生することがあります。

化膿性乳腺炎の治療
1通りが悪いことでたまったミルクに感染しているのですから、そのミルクが通るようになり、乳頭から出てくれれば治ります。ただ痛みが強いので、それを通すためのマッサージは拷問されているように感じるかもしれません。だからこそひどくならないうちに、できるだけつまりが生じないように助産師さんに相談してしっかりと施行しておく必要があります。授乳中は自分でも常にマッサージを適切に施行しておくことがとても大事です。
2それでも回復してこない場合は抗生物質を使います。ただしその際にはその成分はミルクを介して乳児に移行するため、薬の選択に細心の注意が必要です。産婦人科の Dr に処方してもらいましょう。
3これで回復しない場合は断乳が必要になります。ミルクの供給が止まれば感染を増長させている原因がなくなりますから回復します。(ただし感染の元になった細菌の巣は乳管膨大部周辺に残っている可能性があることは意識しておく必要があります。つまり次回の妊娠、授乳期にも再発しやすいのです。)乳腺によく似た器官である汗腺にできるニキビが、思春期に多くできていても成人すれば出なくなるのと同じです。この断乳は赤ちゃんにミルクをあげないようにしてとまるのを待つのではなく、ミルクの分泌が止まる薬剤を飲んで強制的に止めてしまうものです。多くの場合、ミルクの供給が止まれば、炎症は落ち着いていきます。感染のもとがなくなっていくからです。どんなにひどいニキビがあった方でも成人すれば治っていくのと同じです。
4これでもダメな時、外科的に切開し、たまった膿となったミルクを出します。物理的に内容を洗浄し、ドレーンと呼ばれる管を留置します。そこから膿と同時に新しく作られたミルクも流れ出し、もうたまることはありません。細菌が少なくなれば傷はゆっくりと治り、ふさがっていきます。
ここで意識してほしい順序について
われわれのところに1の段階で来られる方がいます。
ただお分かりのように2、3の段階では産科の先生が治療します。
そこを飛ばして4から施行したとしても、いずれにせよ授乳はそこで終わりになります。ミルクが出続けていれば傷がふさがることはなく、清潔になることもないからです。なので、4は緊急時を除いて、2、3で治療できなかった時に施行するものです。
ただ誤解してほしくないのは、決して乳腺科に来るなと言っているのではありません。助産師さんに相談したら、「このしこりはミルクのたまりではない」と言われて精査に来ました、と言われる方もいます。じっさいそうした乳瘤とよばれるしこりと、がんを含めた乳腺の腫瘤は鑑別が難しいことがあります。乳腺と診断されたら、治療はこうした順序で行われます、ということをお伝えしています。
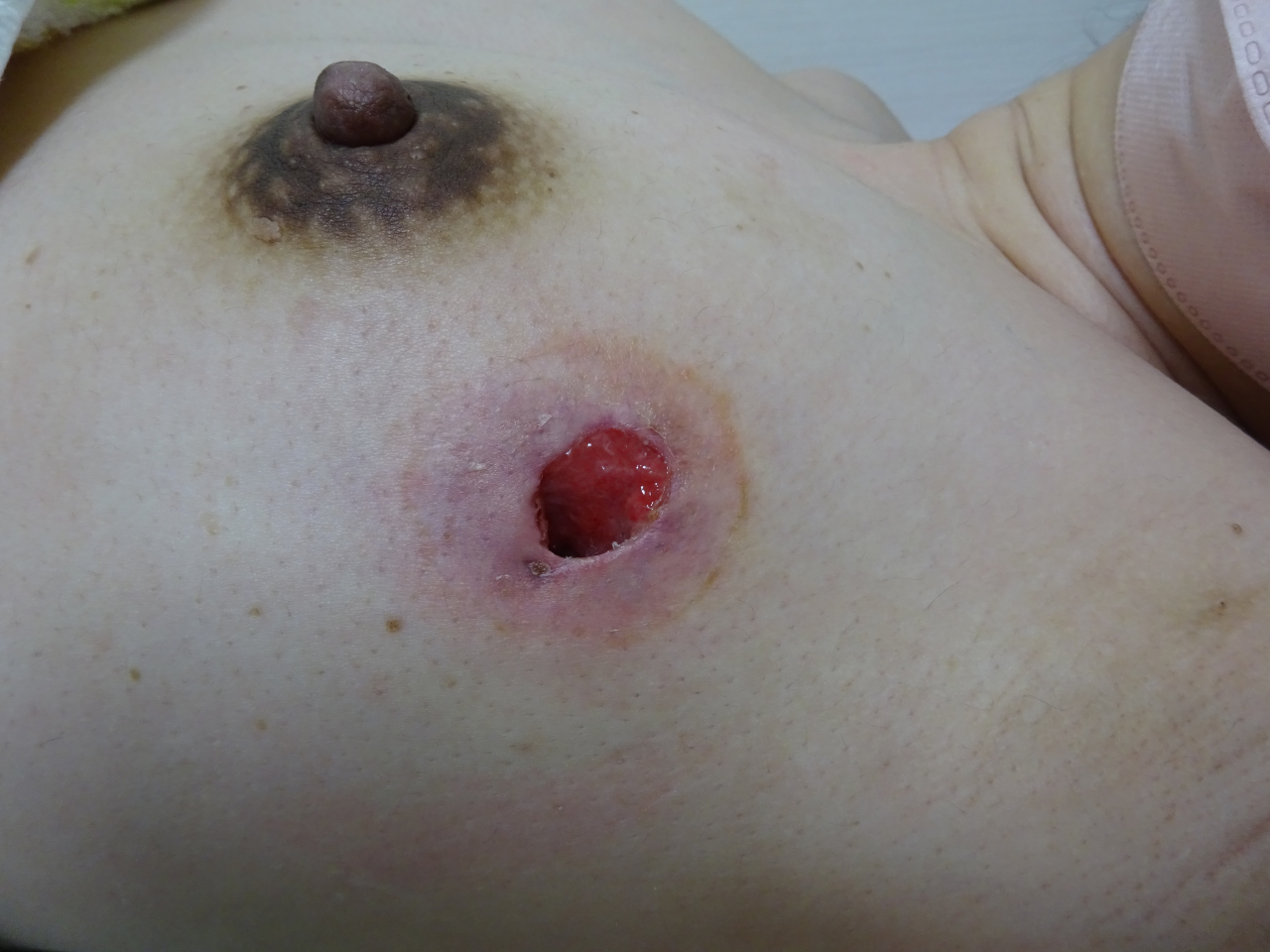
皮膚に穿破した乳腺炎
左 の 写 真 は、 化 膿 性 乳 腺 炎 か ら 膿 瘍 形成 し、 そ れ が 皮 膚 に 穿 通 し た も の です。痛々しいですが、実は逆に穴が空いた時点で熱は下がり、痛みもよくなります。膿みが体外に排出されるためです。
外科的な処置をするときは、膿瘍を切開して結果的にこれと同じものを外科的に作って膿を外に流し出します。つまり外科で処置してもしなくてもいずれはこうなります。
こうなってからミルクを赤ちゃんにあげることはできないことはよくわかると思います。ミルクが出ている限り、そのミルクは乳頭からではなく、一部がこの穴から出続けることになるからです。断乳ができればあとは清潔にしておくことで自然に穴は塞がって治ります。
2022.10.21
HER2陽性乳がんに対しては、今日の分子標的薬剤の躍進の先駆けとなったハーセプチン🄬(トラスツヅマブ)の大成功をはじめ、パージェタ@(ペルツヅマブ)、タイケルブ@(ラパチニブ)、カドサイラ@(トラスツズマブ エムタンシン)、エンハーツ@(トラスツズマブ デルクステカン)と、さまざまな薬剤が開発され、それぞれ臨床において大きな躍進をもたらしてきました。
その進行の速さと、転移のしやすさから、発見時にはそのほとんどがステージII、IIIと進行がんとして発見されるため、治癒が困難で、こうした薬剤が開発されるまでは多くの患者さんが抗がん剤に苦しみ、そして命を奪われてきた歴史があります。
HER2陽性乳がんは、しかしHER2陽性であるがゆえに、これを“標的”とした薬剤が開発され、そしてそれが期待通りの強い抗腫瘍効果があったため、“薬で治る乳がん”として期待が持てるほど予後が改善しています。手術は切ったところしか治せません。ですので、がんの範囲がひろがれば“切りきれない”事態が起こります。しかし薬で治せるようになれば、早期がんだろうが、進行がんだろうが、関係なくなります。どこにどのように存在しても、薬で消えてしまうのであれば、関係ないからです。そして進行して発見されたHER2陽性乳がんは、それでも治せるという期待が持てるがんとなり、その通りの成績を残してきました。
HER2陽性乳がんが、リンパ節に累々と転移をした状態で見つかった。肝臓に転移がある。それでももしかすると治せるかもしれない。分子標的薬剤で治療した。腫瘍が消えてしまった。治ったか!? これは珍しくなくなりました。
乳がんがよく転移する臓器はリンパ節を覗けば、代表的なものは骨ですが、肺、肝臓に加えて、脳にも転移します。
こうした転移を手術で治療するのは難しいため、それこそ分子標的薬剤の出番となるのですが、他の臓器と異なり脳だけは、治療をするにあたって特殊な事情があります。

HER2を標的とする分子標的薬剤は、薬剤として分子量が大きいという特徴があります。
普通の薬をパチンコ玉(タモキシフェン 約564)だとしたら、分子標的薬剤はバスケットボールくらい(分子量, 148,000)の大きさがあるのです。
脳は他の臓器と異なり、血液から“守られて”います。
妙な言い方になりますが、血液から栄養や酸素を大量にもらうのですが、特別なバリア(BBB ブラッドーブレインーバリアといいます)によって、たとえばどこかから血液の中に細菌や毒が入っても、簡単に脳には届かないように守られているのです。
そして分子量が大きい分子標的薬剤はこのバリアが突破できないため、脳に転移した乳がんには届きにくいのです。
分子標的薬剤が開発された当時、HER2陽性乳がんは脳転移しやすい、という噂が立ちました。実際は分子標的薬剤で、リンパ節をはじめ、ほとんどの転移したがん細胞が死滅してしまったのに、脳に転移したがん細胞にだけは薬の効果がなく、生き残り、それだけがのちに転移として出現するため、こうしたうわさになったのです。
HER2陽性乳がんにとって脳転移をいかに治療するか、すでに全身に散らばってしまったがんを根治するにあたって大きな障害になりました。前述しましたが、それさえなければ薬剤だけで乳がんを治せる可能性もすでにあったからです。
最近 米国の臨床腫瘍学会(ASCO)の方から、HER2陽性乳がんの脳転移症例の治療についてガイドラインが出されました。下記にその翻訳を示しますが、難しいと思います。気になる人は参考にしてください。
ただここから読み取れることで今回皆さんに伝えたかったことを抜粋します。
1 原則として、脳転移への治療は“放射線治療”であること。分子標的薬剤の治療は継続でいいのですが、それではコントロールできないから脳転移が出てきているのですから、それ以外の治療が原則になります。この場合、放射線治療が主となります。
2 脳転移が広い範囲に及んでいたり、数が多かったりすれば、全脳照射と言って局所にあてるのではなく、脳すべてに照射を行うことになります。その際、認知症の発症を防ぐために、記憶をつかさどるといわれる海馬(脳の一部分の名前)への照射を可能なら避けること、そして認知症の薬剤であるメマンチンを用いること、を推奨しています。
(3 新しい分子標的薬剤である ツカチニブを用いる可能性について言及していますが、これは、ここでは触れません。日本では未認可で、2022年現在 臨床試験中です)
特に2に関してです。
驚かれた方もおられるかもしれませんが、脳転移に対して脳全体に放射線治療を行うと、脳の代謝が障害され、長期的には認知症を発症する可能性があるのです。もちろん治療をしなければ命にかかわるのですから命と引き換えです。私が治療に携わっていた際も、最後の手段として考えておりましたが、患者さんとも何度も話し合った末、全脳照射に至った方もおられました。
でもいくら命がかかっているとはいっても、記憶がなくなり、認知を発症してまで延命したいと望む方は少ないのが現状でした。
しかしその原因が、海馬への照射によるものであり、それをできるだけ避け、そして予防的に薬剤を投与することで防げるのであれば、そうすべきではないか、そう思います。ただこのメマンチン@(メマンチン塩酸塩)に関しては、日本でも注目されており、様々な学会が取り組んでいますが、現在保険適応外になります。したがって今できる対策は“海馬への照射を(可能であれば、つまりそこにがんがなければ)避ける“ことのみのようです。
それによって記憶がなくなっていくという最悪の合併症が防げるのであれば、その治療を積極的に受けられる方も増えるし、どうしても受けなければならなくなったとしてもためらう理由が軽減されます。
現在 緩和医療に関する学会、脳神経外科関連の学会、さらに放射線治療に関する学会において注目されているようです。そのつもりで探すと山ほど記事が出てきました。薬剤が今は使えなくても近く使えるようになる可能性も高そうです。
対象の患者さんには大きな朗報と思います。私が治療をしていたころには知られていなかった概念ですので、ここで紹介しました。
進行性HER2 陽性乳癌および脳転移の管理: ASCO ガイドラインの更新
*難しいと思います。これを理解しなくても記事はわかると思います。興味がある方のみご参照ください。
生存予後が良好で、1個の脳転移を有する患者の場合、治療オプションには、術後放射線による手術、定位放射線手術 (SRS) 単独、全脳放射線療法 (WBRT) とメマンチン (WB-M) および海馬回避 (HA; ± SRS)、少数分割定位放射線療法、および転移のサイズ、切除可能性、および症状に応じて、無症候性 脳転移を有する選択された患者における全身療法の議論。治療後、局所再発または新しい脳疾患を監視するために、2 ~ 4 か月ごとのMRIやCT検査を施行する場合があります。
生存予後が良好で転移が限定的(2 ~ 4 個)である患者の場合、治療の選択肢には、サイズが大きく、症状の原因となるような病変の切除と、術後放射線療法、追加の小さな病変に対する SRS、SRS(± WB-M および HA)、少分割定位が含まれます。 3~4 cm を超える手術不能な転移には、放射線療法、または WB-M および HA (± SRS)を施行します。
転移が 3 ~ 4 cm 未満の場合、治療オプションには、術後放射線療法による切除、SRS 単独、WB-M および HA (± SRS)、少分割 (SRS)、および無症候性の 脳転移を有する一部の患者における全身療法の検討が含まれます。どちらの場合も、利用可能な選択肢は切除可能性と症状によって異なります。
びまん性疾患および/または広範囲の転移があり、予後がより良好な患者、または脳に症候性軟髄膜転移を有する患者には、SRS または WB-M および HA が提供される場合があります。
症候性の脳軟膜転移を有する患者には、WBRT とメマンチンが提供される場合があります。
予後不良の患者には、WB-M および HA、最善の支持療法、緩和ケアなどの選択肢があります。
初期放射線療法にもかかわらず進行性頭蓋内転移を有する患者の場合、オプションには、SRS、手術、WB-MおよびWB-M、全身療法の試験、臨床試験への登録、および/または初期治療に応じた追加の緩和オプションが含まれます。
脳転移の診断時に全身疾患が進行していない患者については、全身療法を現在のHER2標的療法レジメンから切り替えるべきではありません。
脳転移の診断時に全身疾患が進行している患者の場合、臨床医はHER2陽性転移性乳がんの治療アルゴリズムに従ってHER2標的療法を提供する必要があります。
ツカチニブ + カペシタビン + トラスツズマブの HER2CLIMB レジメンは、HER2 陽性の転移性乳癌患者で、症候性質量効果のない脳転移があり、転移性疾患に対する 1 つ以上の HER2 に向けられた治療で疾患が進行した患者に提供される場合があります。これらの薬剤を使用する場合、頭蓋内での進行が確認されるまで局所療法を延期することがあります。
ツカチニブ + カペシタビン + トラスツズマブの HER2CLIMB レジメンは、局所療法または頭蓋内疾患の進行後に安定した脳転移を有する患者に提供される可能性があります。これは、全身療法ガイドラインの更新版で推奨されている二次治療でのトラスツズマブ デルクステカンのオプションに加えてです。
患者に脳転移の既知の病歴または症状がない場合、MRIによる定期的なサーベイランスの実施を推奨または反対するにはデータが不十分です。
臨床医は、脳の関与を示唆する神経学的症状がある状況では、迅速に診断用のMRI検査を実施する必要があります。
今回の記事は、宣告を受けられた方が、治療開始となるまでの期間、それをどのように過ごすか、について書いたものです。そのため、この記事の対象になる方は大変少ないかもしれません。
その人の仕事や家庭の事情、そして医療施設のアクセス、かかられている医療施設の事情によって、短期間になったり、長期間の待機期間があったりすると思います。それでもそのどうしようもない不安な時間に、こうしたネットを当てもなく読み続けている方も多いと思いますので、ここで記事にすることを思い立ちました。
というのも文春のオンライン記事で、麻央さんのことについて海老蔵が語った記事が載っていたのですが、その内容にどうしても触れておきたいことがあったのです。申し訳ありませんが有料です。気になった方は全文を読んでみてください。ただ私が触れている部分はぎりぎり無料で読める部分です。
我々の施設は検診や二次精査を受け持っています。つまりがんを見つけるのが仕事ですが、がんを見つけても、診断を付けても、治療ができません。したがって治療施設と呼ばれる施設に紹介することになります。最初から治療ができる施設で検診すればいい、そうすれば無駄はない、確かにそうですが、大きな病院、つまり治療施設は紹介状がないと原則受診できません。受診された方のほとんどががんではない検診をしている時間は治療施設にはないのです。ですのでたとえ自分でしこりを見つけて気になる、となったとしても大学病院や、がん専門施設に直接受診することは原則できません。我々のような施設や、どこかかかりつけ医に相談して、紹介状をもらって受診することになります。ですからどうしても診断がついてから、治療施設の受診ができるまで、時間のロスが生じます。
ただ我々の施設は自分のところで診断を付けるところまで行えます。そのため、かかりつけ医が乳腺の施設ではない場合(ほとんどがそうですが)、紹介状をもって治療施設を受診し、まず診断を付けてもらうことになります。それよりは時間の節約になります。治療施設であっても診断がつかなければ治療は始まりません。気軽に何でも相談できるかかりつけ医は大変ありがたい存在で、皆さんの健康にとても大切ですが、我々の施設に来て診断がつけば、実は時間的には少し得になります。
ただ治療施設の事情によっては、せっかく診断を付けても、それから初診まで待ち時間が生じることがあります。いわゆる予約待ちです。長い時で2か月近く待たされることがあります。
「え、がんなのに、2か月も待たされるの!?死んでしまう!」
たまらない時間です。ただでも不安で仕方がないのに、何もできないまま時間だけが過ぎていく。そうしている間にもがんは進んでしまうかもしれないのに。
内情を話すと、日本と同じく国民皆保険制度があるイギリスでは6か月以上待ちがほぼ当然、とのことですから、世界的な事情からはまだそれでもましな方なのです。たとえばフランスでは保険で受診できる、その代わり待期期間がとんでもなく長い施設、と、すぐ診てくれて医療レベルも高い、けれども全額自費、の施設とがあるそうです。英国もいざとなれば隣の国の自費診療に受診するそうです。それから言えば、自分の命も金次第、とはなっていないだけ日本はましともいえます。私の知る限り、いつでもなんでも診ます、でも自費です、という病院はまだありませんから。産油国のように贅沢にお金をつぎ込めばなんだってできますが、必要最低限で節約しながら医療費を分配している日本では、1-2か月待ちで優秀ながん治療にアクセスできることはほぼ奇跡ともいえるのです。
話を戻します。上記の事情はわかったとしてもそれでも不安です。
「なにか、この時間でできることはないの?」
誰しもそう思うと思います。
我々の施設では、この待期期間を過ごさなければならない方に、小冊子を渡して読んでもらっています。
この時間にできることはないのか、の疑問に答えるためです。ここでその内容を全て載せると紙面が足らないので、かいつまんで書きます。
1 いままでの普段の生活を極端にかえないこと。食事制限や極端なダイエットをしない(この記事を参考にしてください)
2 仕事を辞めてしまうのは、必要に迫られてから。多くの場合で仕事をつづけながら治療は可能です。入院も1週間程度がほとんどです。生活習慣を極端に変えると体調を崩しがちですし、なにより仕事を辞めてまで作った時間でやらなくてはならないほどのことが今のタイミングではありません。上司に相談しておく程度にしておきましょう。
3 できるだけ適正体重に近づけておいた方がいいため、規則正しい運動を無理のない程度に初めておく。これは抗がん剤を使用することになった際に、主に体重で投与量が計算されるからです。皮下脂肪の分、余計にしんどい思いはしたくありません。ただ食事制限で痩せると体力も落ちます。ですので運動を勧めているのです。
4 歯科受診をしておきましょう。これはがんに罹患し、抗がん剤が必要になるかもしれないので、ときちんと歯科主治医に伝えたえで受診してください。
これは現在、私が宣告した患者さんが治療施設を受診されるまでの待期期間のために渡していますが、私が治療施設で勤務していた時も、初診から手術予定日の間の待期期間のために渡していました。私の患者さんは皆さん読まれた記憶があると思います。特に4について強調していたので、覚えてくださっている方も多いでしょう。
文春の記事を読んで、そうだったんだ、と驚かされた記載がありました。
海老蔵さんのインタビューによると、気功を含む民間療法に頼って治療が遅れた、などいろいろなところで書かれているけれども、麻央さんは普通に抗がん剤治療を含めた標準治療を受けることが決まっていたのだそうです。ただその予定日の直前に、抜歯をしてしまっており、治療が2週間遅れたのだそうです。その2週間の間にいろいろなことがあって、治療の方針が大きく変わってしまった、あの2週間がなかったら、運命は変わっていたかもしれない、そう書かれていました。
海老蔵さんに関してはいろいろなところでいろいろと書かれているのでよく思っていない方もおられるかもしれませんが、この内容は、実際に経験していない方はまず言えませんし、思いつかないでしょう。事実だと思います。


私が乳がん患者さんに、治療開始前の歯科受診をこのように勧め始めたのは20年近く前からです。
もともとの話をします。
40代後半の患者さんが、乳がんの診断後に治療を地元にかえって受けられることになり、K大学病院に紹介状を書きました。残念ながら抗がん剤が必要な方で、それも手術より優先的に(先に)抗がん剤をされることになることはわかっていた方でした。
「やっと治療開始です」
紹介状をお渡しし、1カ月後、ご挨拶に来てくださった患者さん、
でしたが、なんとすべての歯が抜歯されていました。繰り返しますが、全部、一本残らず抜歯、40歳代後半です。
治療前に調べたら虫歯が3本あって、治療していたら時間がかかるから、と、全身麻酔 1泊2日で全部抜かれたのだそうです。まだ入れ歯ができていなくて、マスクを外したお顔を見たときそのあまりの変わりように絶句しました。
ああ、私は甘い、そう思いました。
私の患者さんでも、歯科受診を話をすると、「先生、虫歯くらい我慢しますから、がんの治療を優先してください」そう言われる方も多いです。皆さん痛みなら我慢する、そう思っておられる。でも怖いのは痛みではないのです。
抗がん剤をすると免疫が落ちます。感染に弱くなる。齲歯、つまり虫歯は細菌感染によって引き起こされます。歯髄は骨髄につながっています。重症化すると骨髄炎になる可能性があります。虫歯がなくても歯槽膿漏があれば細菌が関与しています、ですので同様です。
歯は頭蓋骨に埋まっています。つまり骨髄炎は頭蓋骨に起こる。そう細菌性髄膜炎、そして脳炎になる可能性もあるのです。事実K大学病院で、以前一人それが原因で亡くなっているのだそうです。以来K大学では抗がん剤が必要な患者さんに口腔管理が徹底されているとのこと。実は歯は細菌の住処であり、口腔内は歯がなくなると清潔が保たれやすくなるのです。おそらく麻央さんの治療施設でも、抜歯したばかりで歯髄がむき出しになり、感染に弱くなっている状況で、抗がん剤の導入によって免疫が急激に下がる状況を恐れたのでしょう。抗がん剤は最初の1回目がもっとも白血球が下がりやすく、生体の環境が激変するため、何が起こるか予想がつきにくいのです。
それ以来 私は自分の患者さんが治療が始まるまでの待ち時間に対して、不安を訴えられるたびにお話ししてきました、「やっておかないといけないことはあります」
麻央さんに関しても、海老蔵さんがあれがなければ…と話されていたことが歯科処置だったことに改めて驚かされました。そしていままでそれを勧めてきたことで、何人かの患者さんの運命が、良い方向に変わっていたのではないか、とうれしく思った次第です。
皆さんも、もしその立場の方は受診しておきましょう。損はないはずです。
そしてその立場にない方も頭の片隅に置いておいてください。乳がんに限らず、がんの治療の際には役立つ知識のはずです。
2022.03.11
原則として、対側に発生した乳がんは、再発ではなく、新しく発生した乳がんである。
それが言えるのはなぜでしょうか。
乳がんの手術を受けられた方の中には、”センチネルリンパ節生検”を受けられた方もおられると思います。実はこの手術方法が開発されるまで、乳がんの手術は乳腺の切除に加えて、常に腋窩(わきの下)のリンパ節の郭清(根こそぎ切除すること)が行われていました。
乳がんに限らず、がんの最も恐ろしいのは転移です。そしてその多くは最初から見つかっていることはまれで、治療が終わったころ、あるいは何年もたってから見つかります。最初は小さいので、検査をしても見つからないのです。もし乳がんの細胞がすでに乳腺から飛び出し、こうした目に見えない転移が、肝臓や肺にあれば手術だけでは治りません。抗がん剤や、ホルモン剤、放射線治療などの治療が手術に加えて必要になります。しかしだからといって抗がん剤治療などは特に受けたくはないでしょう。まして転移がない可能性が高いのに、一律全員に施行されたらいやですよね。
そこで、乳がんがもし乳腺から飛び出し、他の臓器に転移していく際に、最初に転移をすることがよく知られている腋窩のリンパ節に目を付けたのです。
つまりもし乳がんの手術の際に採取された腋窩のリンパ節に転移があれば、そこから先の他の臓器にも見えない転移があるとして、抗がん剤を含めて治療をしておくべきと考える。逆に腋窩リンパ節に転移がないようであれば、その先の臓器にも転移していることはまれとして、体に害のある抗がん剤は施行しない、となりました。(もちろんそれほど単純ではなく、原則であって、例外はあります。)
腋窩リンパ節の郭清は、特に手術前の検査で転移していることが明らかな場合を除けば、それによってがんを取り去る、治療することを目的としているよりも、それによって転移が隠れている可能性を正確に判断し、抗がん剤治療が必要な方に適切に抗がん剤治療を行う、そのための検査のニュアンスが強いのです。
そしてそれを突き詰めれば、何も腋窩のリンパ節を根こそぎ取らなくても、乳腺からのリンパの流れを最初に受けているリンパ節、すなわちセンチネル(見張り)リンパ節だけとって調べれば目的は達することができます。
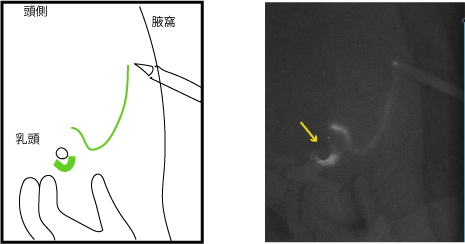
上の図を見てください。右の暗い写真がセンチネルリンパ節を同定しに行っている術中写真です。
左に図を載せました。図の緑の線に沿って、写真ではインクが光っており、黄色い矢印が乳頭部です。
この図でもわかるように、がん周囲に注射された生体インクは、まず乳頭周囲に集まり、そこから腋窩に向けて一直線に流れていっています。
術前検査で、明らかな転移はない、と診断された乳がん患者さんには原則このセンチネルリンパ節生検が行われます。ということはほとんど例外なく、がんから出たリンパの流れは腋窩のリンパ節に向かう、ということなのです。
さて、ここで最初に戻りましょう。
なぜ対側に発生した乳がんは、原則として再発ではなく、原則である、と言えるのか。
それはこう言いかえることができます。腋窩のリンパ節や、もともとのがんがあった側の乳腺周囲のリンパ節に転移、再発がないのに、いきなり反対側の乳腺に、がん細胞が流れ込むようなことはまず考えにくいから、なのです。
逆に、もし腋窩リンパ節にもたくさん転移があった、首の回り、胸の中、心臓の回りなど、もともと乳がんがあった側の、腋窩や鎖骨周りのリンパ節にたくさん転移があって、それが体の正中のリンパ節にまで及んでいた場合には、対側乳腺に転移することはあり得ます。ただその場合は対側乳腺に転移した、再発した、というよりも、ほぼ全身に転移したがんの一部が対側の乳腺にもある、ということになりますので、今回の質問の趣旨からは外れると思います。(もちろんそれはとても悲しいことですけれども)
もし乳がんの術後に反対側に乳がんが見つかったら再発ですか?
この問題に回答するために考えなければならない3つの要素
1 その反対側の新しいがんは、もともとのがんと病理学的に”同じ”ですか?
(おそらく”病理学的に”は将来的に、”遺伝子的に異常をきたしている部位が” に代わるでしょう。そうなればもはや残りの二つは不要です。)
2 その新しいがんは、もともとのがんとどれくらいの時間的な間隔があいて見つかりましたか?1年?3年?5年?10年?それ以上?
3 最初のがんは、リンパ節転移や、皮膚浸潤など、進行がんであることを示していましたか?それとも全く転移のないがんでしたか?
今回、この3の要素について、経路という考えから説明しました。
これらのことから、もし逆に再発や、転移を疑う対側乳腺のがんとは、
病理学的に同じものが、最初のがんからあまり間隔を置かずに発生し、そしてもともとのがんが腋窩転移を伴っていたなど進行がんであった、その場合に限られる、となります。
最近 Lanset Oncologyという雑誌に、このブログの第4回の趣旨とほぼ同じ内容の論文が発表されました。つまりタモキシフェン VS アロマターゼ阻害剤というテーマです。
私がブログで論じた内容と異なり、この論文がユニークなのは、この論文は”閉経前”患者さんについて書かれたものであることです。本来 閉経前患者さんにそのままアロマターゼ阻害剤を用いても効果はありません。ですので閉経前の患者さんであれば手術や薬剤など、何らかの方法で卵巣機能を抑制し、閉経状態としてから用います。
メタアナリシスという、こうした議論をするには最も信頼できるデータを提示できる方法で検討されていますので、ここでもう一度触れてみたいと思います。
英語版でよければここから読めます。
Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials
www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00758-0/fulltext
ちなみにメタアナリシスというのは、前向きランダマイズ(二重盲検)という、単独でも十分に信頼性の高い方法で検証された論文を、さらに同様のテーマのものを数個以上集めてさらに検討するという方法です。たとえば過去に標準治療とされてきた治療法を、新しい治療法、薬剤に置き換えてしまう場合に行われる検証法で、臨床における研究方法ではこれ以上信頼できる方法が今のところありません。
そこでメタアナリシスで結論が出れば、以降はそれが世界的に標準治療になります。
それが2022年2月3日付の論文で出てくるのですから、このタモキシフェン VS アロマターゼ阻害剤というテーマは、私がブログを書いた時点ではやはり結論が出ていなかった、と言ってもいいのでしょう。
それでは今回の論文ではこの比較検討に結論が出たのでしょうか。
ここで第4回の復習をしておきましょう。
・アロマターゼ阻害剤はタモキシフェンと比較して、ハザード比で0.8前後をもって乳がんの再発を抑制する。
・アロマターゼ阻害剤ではタモキシフェンと比較して、骨折の頻度を含めて、骨粗鬆に関する副作用が頻発する。
・タモキシフェンは、アロマターゼ阻害剤と異なり、子宮体がんの確率が増える副作用を持つとされるが、統計的にみると、乳がん以外のがん死は、タモキシフェンとアロマターゼ阻害剤で差が認められない。
ただしこれは閉経後患者さんに関する検討をもとに述べたものでした。

今回の論文ではABCSG XII、SOFT、TEXT、HOBOE試験という4つの論文からデータを集めました。ホルモン剤に対する感受性を有する乳がん患者さんをなんと合計で7,030例、平均8.0年追跡して得られたものです。
結論ですが、アロマターゼ阻害剤はタモキシフェンと比較して、ハザード比で0.79で乳がんの再発を抑制していました(RR:0.79、95%信頼区間 0.69~0.90、p=0.0005)。これは第4回の結論と同じです。乳がんの再発抑制効果については、閉経前の患者さんであっても、アロマターゼ阻害剤はタモキシフェンよりも優れていることが確認された、としていいでしょう
これはもはや揺らがない事実としていいでしょう。ほかの要素を加味せず、乳がんの再発抑制だけを考えるなら、あるいは最優先とするなら、アロマターゼ阻害剤は第一選択です。ただしここで繰り返しますが、アロマターゼ阻害剤”単独”では閉経前の患者さんに効果はありません。卵巣を薬剤で抑制しておく、手術で切除されている、ことが前提として必要になります。この試験もその条件で行われています。
タモキシフェンをアロマターゼ阻害剤とする再発抑制効果の違いは、治療開始から4年間に認められており、5年再発リスクの絶対値で3.2%低下していました(5年間で再発するリスクとしてアロマターゼ阻害薬 6.9% 、タモキシフェン 10.1%)。
しかしそれ以降 5-9年、そして10年以降では、タモキシフェンをアロマターゼ阻害剤とするメリットは認められませんでした。
・乳がんによる死亡、再発を伴わない死亡、全死因死亡に関しては治療間の有意差は認められませんでした。これに関しても第4回に触れたことと同じです。
ただ 全死因の死亡では乳がん以外のすべての亡くなった患者さんをカウントしていますのでまだわかるのですが、乳がんの再発を確実に抑制するのに、乳がんによる死亡では差が出ないのはなぜなのでしょうか。そこはどうしても納得のいかないところです。また機会を改めてその点を解説してみたいと考えていますが、少なくとも再発を抑制する効果が、すぐさま生死にかかわるレベルにまで影響するほど大きくない、ことは言えるのではないでしょうか。
そして気になる骨粗鬆に関する副作用ですが、これもアロマターゼ阻害薬は、タモキシフェンよりも骨折が多かったことが明らかになりました。ハザード比 1.27ですので、第4回に合わせるなら、タモキシフェンはハザード0.73で骨折を抑制します(本当はこんな逆算みたいなことをしてはいけません。参考としてみてください)。これもまた第4回に書いたことと同じです。
結局 第4回で書いたこと、大きな3つの要点は閉経前の患者さんでも言えました。
ただ閉経前患者さんは若い方が当然多い。なので少しでも再発を抑制できるアロマターゼ阻害剤を選択したい気持ちは強いでしょう。ましてStage II、III、あるいはリンパ節転移があった、など進行がんとされた方ではなおさらなのではないでしょうか。

これは大変不思議なこと、これは論文の中で筆者の先生も書かれていることなのですが、
リンパ節転移が多かった方、0個よりも1-3個、4個以上の方と多ければ多いほど、転移の傾向を表し、よりがんが進んでいることを表しているとされます。したがってアロマターゼ阻害剤の転移抑制効果はより強く出るのではないか、誰もがそう期待します。ところが下の図を見てください。

図 右下の方に左右に開く矢印があります。(このような図をForest (Tree)Plotと言います)
Favours aromatase inhibitor(アロマターゼ阻害剤のほうが優れている)
Favours tamoxifen(タモキシフェンのほうが優れている)という矢印です。
図左上 N0はリンパ節転移無し N1-3は1個から3個の転移、N4+はそれ以上の数のリンパ節に転移があったということです。そして下に行けば行くほど、図では■と横線が右へ、つまり「タモキシフェンのほうが優れている」に移動しているのです。
この現象は少なくとも、閉経後の患者さんに対する検討では認められませんでした。さすがに筆者も理由を推理できなかったようです。少なくとも自分は進行がんだったから、タモキシフェンよりもアロマターゼ阻害剤だ、と単純には決められないことが示されてしまいました。
筆者の先生も、これは今回の検討でもっとも予想外だった結果になる、と書かれていました。

Forest Plot に触れましたので もう一つの図を紹介させてください。
実は中心の1.0の垂直線を、横線がまたいでいる場合と、またいでおらず、完全に片方によってしまっている場合では、後者の方が ”信頼できる結論”とされています。
上から、乳がん以外のがんによる死亡、ですが、"タモキシフェンのほうが優れている”に振れていますがまたいでいます。
2番目、子宮体がん(Endometrial cancer)、これは左、つまりアロマターゼ阻害剤が優れる、に振れていますが、またいでいます
Bone fracture、骨折ですが、これはタモキシフェンが優れる、に完全に振れています。
タモキシフェンを飲まれる方は、子宮体がんの検診は受けておくべきだけれども、それで亡くなってしまうようなことは、必要以上に恐れなくてもよい、とは言っていいのではないでしょうか。
ここまでの結論
閉経前の患者さんであっても、LH-RHアゴニスト(ゾラデックスやリュープリン)を使用すれば、閉経後と同じ状況になるので、アロマターゼ阻害剤(アリミデックス アロマシン フェマーラ)が使えます。
タモキシフェン VS アロマターゼ阻害剤では、少なくとも再発抑制効果において、アロマターゼ阻害剤の完全勝利です。大体100点と80点の差があります。
それならばすべての患者さんがアロマターゼ阻害剤(閉経前であればそれ+LH-RH)でいいはずです。それならばタモキシフェンはもう消えているはずです。
アロマターゼ阻害剤 Vs タモキシフェン は決着がついたとは言えないように思っています。それでもやはり進行したがんであればアロマターゼ阻害剤を選択するように治療方針を立てますし、骨折によって極端にADL(日常生活や活動)が損なわれてしまう年齢の方で、早期乳がんであればタモキシフェンよりに考えます。
アロマターゼ阻害剤を選択していたとしても、5年以上再発なく経過され、骨粗鬆に由来する訴え、膝の痛みや、手指のこわばりが不快な方では、定期的な婦人科受診を前提として、タモキシフェンへの切り替えを提案していくと思います。
主治医が、その患者さんと話し合いながら、その状況に応じて選択していくべきであって、盲目的に、単純反射的にアロマターゼ阻害剤を第一選択することは、正しいとは言えないと思います。
2022.02.07
皆さんは抗がん剤は嫌いですよね。
医者も嫌いと言われる方が多いです。病院が嫌い、注射が嫌い、よく言われます。
ただ悪いのは病気であって、病院や医者、注射が悪いのではない。まして抗がん剤が悪いのではない。それはだれも頭では理解できている。でも体が嫌と言います。病気を治したいのに、なぜ病気のような苦しみ、髪の毛が抜けたり、食欲が落ちたり、吐き気に苦しまなければならないのか。それじゃ治したいのに、病気になるようなものじゃないか、そういうことと思います。
ただ病気に文句を言っても聞いてくれないからと言って、医師に噛みつかれる方もまれにおられますが、我々はあくまで”味方”です。敵ではない。それは忘れないでください。
同じように、ホルモン剤も、抗がん剤も、手術も放射線治療も、がんと闘うための手段であって、優劣はありません。効果の有る、無しがあるだけです。その意味からは優劣はありますが、それはその患者さんごとに異なります。その患者さんには抗がん剤治療をしておくことが最善であれば、抗がん剤はその患者さんにとって優れた治療なのです。
そんなわかりきったこと、と思われた方も多いかもしれません。
さて本題です。先日ある患者さんからこれを読んでくれ、と本を渡されました。医師の書いたもので、抗がん剤投与についてその先生独自の視点を述べられたものです。その患者さんは、この先生のような治療をしてもらいたいけれども、この先生は亡くなっていてすでにいないから、先生がこの先生の治療法を学んでほしい、ということでした。(具体的な題名や、著者名は伏せさせてください)
その先生独自の治療方針、治療哲学は、簡単に言い切ってしまうと、抗がん剤を”標準治療”として推奨される量よりも少なく(半量で)開始するというものです。たとえば 1回に2-3滴と添付文章に書かれている目薬なら、1滴しかしない、そういった使い方です。特に再発患者さんでは、抗がん剤を使用しても治癒を望めない方も多い、ならば苦しみの多い抗がん剤を一律に使うのではなく、効果を見ながらできるだけ少なく使うことを心がけるべきだ。
一見正しく聞こえます。化学治療を減量することに反対ではありません。私も副作用を鑑みて、減量することはします。この先生はしかし最初から半量で開始する、そこが独自なのです。
私はその本を読んだうえで、その患者さんに、この治療方針には従えません、と言いました。
ここからはそれに対する私の反論を書かせてください。

この本は、書き始めから半分まで、現状の化学治療中心、腫瘍内科医中心の乳がん治療を憂いていることが書かれています。わが国では5大がんと言われるがん種の中で、乳がんだけがそれを専門とする内科医がいませんでした。消化器内科、呼吸器内科、肝臓内科もいますが、乳腺内科はいません。ですのでいままでは私や、この本の著者のような外科医が、“片手間”に化学治療をしていました(認めたくありませんが、内科の先生からは外科医には外科医の仕事があるのだからそうなります)。しかし腫瘍内科、正確には化学治療を専門とする内科医である薬物治療専門医の登場によって、これからは“本業の”内科医が化学治療を担うといわれています。それによる弊害について、前半に延々と述べられているのです。
そこで何が問題なのか? 簡単に言えば、化学治療が本業である彼らは、ただひたすらに抗がん剤治療を推し進めると。そしてそこには患者さんの苦しみや希望は反映されず、一律に抗がん剤の大量投与が行われていると。密接につながる製薬会社、そして特許を巡る膨大な利益とその権利誘導、そのためにガイドラインが用いられると。陰謀論が論じられます。ただ彼の指摘していることでもありますが、膨らみ続ける医療費が問題であることは確かな事実であり、皆の知ることです。 それが必ずしもそのためとは思いませんが。
ただ、だからといって筆者の先生の独自の治療法、正規の半分や3分の1の量を最初から投与するやり方が正しいことになりません。
ただもちろん間違いとも言えません。どちらも正式に調査されていないからです。
この本の趣旨はこうなります。
1 現在は、化学治療を妄信する腫瘍内科医たちが、患者の状態も考えずにひたすら抗がん剤を“大量”(と言っても決して主治医の自己判断による投与量ではありません)投与している。
2 だからたとえ延命できてもボロボロになっている人や、副作用でむしろ短命に終わる人も筆者はみてきた。
3 筆者は、効いてさえいれば、抗がん剤の量を(自己判断で)、減量して開始したり、減量したりしながら投与している。
4 それでよかった患者さんを経験している。 だから私の治療方針は正しい。
こうした本はたくさん出ていますが、前半は著者の先生が普段感じていることに対するエッセイなので反論はありません。本ですので意見や感想を述べることはだれにも自由です。
ただ後半は賛成できません。他人が誤っている、だから、自分は正しい、ということにはなりません。
本来、患者さんの状況を考えず、大量の抗がん剤を投与し続けたり、そのために副作用で短命に終わらせてしまったりしたとしたら、それも薬物治療専門医が“自己判断”で抗がん剤を施行したから、と考えるべきです。つまり筆者のやっている間違いと同じなのです。標準治療は、薬剤を推奨量から開始し、効果と副作用を見ながら適切に減量することを含みます。それをせずに患者さんを苦しめたとしたら、それは標準治療がそもそもできていません。独断で少ない量から初めて、だんだん増量するやり方は、標準治療ではありません。それは、増量する前に投与そのものを中止してしまい、効果がなかった、と判断してしまう恐れがあるからです。
こうしたガイドラインに書かれている標準治療、そして薬剤の投与推奨量、治療のスケジュールは、それ以外の治療法と比較して、“延命でき、同時にQOLを損なわないことがすでに証明されて”いるものです。その通りにならなかったとしたら、それを運用した主治医が間違ったのです。主治医の先生が標準治療を語りながら、自己判断で間違った運用をした、ということになります。

標準治療は、患者さんのためにあるのであって、それを正しく用いたら患者さんはQOLを落とすことなく延命できる、はずなのです。
筆者の先生は、標準治療の名を語ってお金儲けや、名誉のために、抗がん剤を“やりまくる”悪党がいる、という前提で治療を語っています。薬物治療専門医の中にもそうした先生もいるかもしれませんが、私はむしろ筆者のように自己判断で薬の量を勝手に変えてしまわれる先生方の中にこそ、そうした先生は多いように思います。そして標準治療すべてを誤りとするのは明らかに間違いであって、それを運用する医師の技量を問題にするべきです。
この本を私に勧めた患者さんにも言えることなのでしょうが、どこまで行っても主治医と患者との信頼関係であって、結局この本はそのことを言っているにすぎません。その先生を信頼してついて行かれる患者さんも決して間違いではないでしょう。結果は必ずしもいいものばかりではない。がんはなおさらです。だからこそ、後悔のないようにすることが最も大事なことだからです。
繰り返しますが、この筆者の先生が出している根拠では、標準治療が間違っていることを証明できませんし、筆者の先生の治療法が正しい証明にもなりません。
もし薬物治療の専門医の行う標準治療と、この先生が行う独自の治療の、どちらが優れているか、を正しく比較するならば、すべての薬物治療医が正しいと認め、そして主治医として患者さんから信頼されている先生が行っている標準治療と、この先生の独自治療を比べるべきです。
薬物治療専門医が治療をし、結果的に悲惨な状況になられた患者さんが、この筆者の先生を訪ねてこられたから、そしてその方をいい方向にこの先生が導けたから、そしてその筆者がそのエピソードをピックアップして自費出版しているから、それだけではこの先生の独自の治療法が正しいことにはなりません。
もしかしたらこの先生のところから逃げ出して、標準治療をしている先生に駆け込んだ方がおられるかもしれないではないですか。それを引き受けた先生は、他人の批判はせず、黙って患者さんのために黙々と治療されているかもしれません。
このような場合、今まで自分が受けていた治療が間違っていた、患者さんにとってそう思うことは悲劇しか生みません。もう過去には戻れないからです。訴訟をして、賠償金が取れれば多少は取り返せるかもしれませんが、それは法律的に誤ったことをしている場合だけです。結果だけで罪に問われることはありません。だから医師は前医の治療に問題があることに気づいても、そのことを非難はしません。だれも得しないからです。自分の正しいと思うことを黙々と患者さんのためだけを考えて実行します。
よかったら“ヒポクラテスの誓い”を読んでみてください。今でも医師ならば大切にしているし、医師ならば最初に守るべき哲学ではないでしょうか。そこでは部下や、若さに関係なく、看護師や薬剤師などの立場に関係なく、医療に従事する者すべてを信頼し、敬意を払う、とあります。
筆者の先生の主張が、間違いであることがよくわかります。
医師は、もしほかの医師が間違っていたなら、その医師に直接会って、批判し、討論します。どちらが正しいか、わからないからです。しかしたとえそれで結論が出て、片方が間違っていたとしても、それを患者さんには伝えません。理由は先に述べたとおりです。ましてや前医の治療方針を、結果が悪かったからと言って、一方的に患者に伝えることはしません。前医、後医といって、前の治療の結果から判断できる後から診る医師のほうが圧倒的に有利だからです。
以上が、この本(ごめんなさい、名前は出せません)に対する私の反論になります。
皆さんにも役に立てばと思って載せました。長文のお付き合い有難うございました。
乳がん術後の再発抑制効果はアロマターゼ阻害剤がタモキシフェンなどのSERM薬剤よりも強い。そのことは紛れもない事実です。
先に触れたとおり、代表的なアロマターゼ阻害剤はハザード比にして0.8前後の再発抑制効果を持ちます。ハザード比 0.8というのはどういうことか。
タモキシフェンががんの再発を抑制しないというのではないのです。
乳がん学会のガイドラインでも「タモキシフェンは,浸潤性乳癌の術後,転移・再発乳癌に対してのみならず,非浸潤乳癌の術後,乳癌発症高リスク例の乳癌発症予防にも有効性が示されている」とあります。
ホルモン剤を使用しない、ことと比較してタモキシフェンの無病生存期間(DFS)に与える影響は HR 0.64です。つまりタモキシフェンは、その使用によってホルモン剤を使用しない人と比較してハザード比にして0.64前後の再発抑制効果を持ちます
何も治療しなければ100人再発するとすればタモキシフェン使用(0.64)でそれが64人にまで減ります。
再発が64人起こることが予想される患者さん群に対して、そのホルモン剤をタモキシフェンではなく、アロマターゼ阻害剤(HR0.82で計算します)を用いることにより、52人に減らすことができる、ということです。AIは、タモキシフェンよりも12人とより多く救うことができる。これは文句なく素晴らしいことです。それは否定しようもありません。
ただここでもう一つ考えてほしいことがあります。
乳がんの患者さんには早期発見された患者さんもおられれば、進行して発見された患者さんもおられます。もちろん再発は、早期だろうが、進行していようが防げるものなら防がないといけないし、何としても避けなければいけない。しかしその確率に差があるのは事実です。ホルモン剤が効果がある方は、原則として効果のない方、トリプルネガティブタイプやHER2エンリッチタイプの方より、予後は良好です。
現状ステージ I の早期乳がんの方で再発せずに5年間無事経過される方は98%です。つまりステージ1の早期がんの患者さんであれば、5年後に100人に2名の患者さんが再発されます。
ハザード比が0.82では、タモキシフェンをアロマターゼ阻害剤に変更しても、アロマターゼ阻害剤をタモキシフェンに変更しても、現状では影響を受けるのは1名もおられない、という計算になります。早期がんであればタモキシフェンであっても再発される方はもともと少ないので、タモキシフェンをAIに変更しても恩恵を受けられる方はそれほど多くないのです。

命がかかっていることで、多いも少ないもないだろう。
それはそうです。ただお薬ですから副作用も考える必要があります。
たしかに性ホルモンですから、インシュリンのように0になっても生命に直接は関与しません。ただ女性ホルモンが減少し、更年期で苦しんでおられる方が多いことでもわかるように、ただただ0を目指せばいいものでもありません。
ここで思い出してもらいたいことがあります。
アロマターゼ阻害剤は、女性ホルモンの働きをすべてブロックするのに対し、タモキシフェンは”骨”と”子宮”に対しては、むしろ刺激する方に働きます。

これは第2回の復習になりますが、アロマターゼ阻害剤は女性ホルモンというカギそのものをすべて抑え込んでしまいます。タモキシフェンは偽カギです。乳腺の鍵穴に刺さって、塞いでしまうので、女性ホルモンが働かなくなります。ただ骨と子宮の鍵穴には刺さって”回せる”ので、刺激してしまうのです。
骨に対してはこれはしかしいい効果になります。
アロマターゼの副作用で、骨粗鬆はよく知られています。しかしタモキシフェンはむしろ逆に骨粗鬆を防ぐ働きをします。
ただ子宮に対しても刺激することは、いいことばかりではありません。本来閉経して痩せていくはずの子宮内膜が、刺激されて厚くなってしまうので、子宮体がんの検診が難しくなります。さらにわずかですが子宮体がんの率が上昇することが知られています。
先ほどハザード比という話をしました。骨粗鬆の最悪のイベントは骨折です。
ご高齢の女性にとって、骨折する場所によっては長期臥床につながる恐れもあります。AIは閉経後女性が対象ですから、高齢の方が多く、問題になることも多くなります。
これに関してはアリミデックスについて行われたATAC試験で詳細な結果が示されています。

5年後にホルモン剤を中止すれば、両群で差はなくなっていきますが、飲用が継続されている5年間では常にアリミデックス(アロマターゼ阻害剤)を飲んでおられる方の骨折の発生率が、タモキシフェンを飲んでいる方を上回っています。平均すれば年に3%前後、と2%前後の差がある、と言い切っても賛成していただけるでしょう。もしハザードにすればこれはタモキシフェンを飲むことで、アロマターゼ阻害剤によって引き起こされる骨折とハザード比で0.66の差がある、と言い直せると思います。
つまり、アロマターゼ阻害剤はタモキシフェンよりもハザード比0.8で再発を抑制するが、タモキシフェンはアロマターゼ阻害剤よりもハザード比0.66で骨折を抑制する、と言えてしまうのです。
「おいおい、再発と骨折を一緒にするのか?再発は命に直結するけれど、骨折しても直せばいいじゃないか」そういう声もあるでしょう。
ただ、ご高齢の方にとって、もし長期臥床、そして寝たきりになってしまわれれば、長生きできてもうれしくない、と言われる方もおられるかもしれません。また骨折にまで至らなくても、膝痛、腰痛など、動作時に痛みが継続すれば日常生活がつらいものになります。あるかどうかわからない再発よりも、この関節痛を何とかしてくれ、そう言われる方もご高齢になればなるほど増えていくことは理解できます。
その意味から、少なくともご高齢、かつ早期乳がんの方に関していえば、一律 アロマターゼ阻害剤が一択だ、とは言えなくなります。
子宮体がんについてはどうなんだ、増えるのだろう?
そういう声もあるでしょう。再発の抑制効果に劣り、子宮体がんの確率がわずかながら上昇する。
どちらも命に係わるものなので、深刻に見えます。ただそれならばタモキシフェンを飲まれておられた方は、アロマターゼ阻害剤を飲まれていた方よりも、なんだかんだで長生きできていない、という結果になることが予想されます。
これもATAC試験に答えが示されています。

このデータはこのアリミデックスとタモキシフェンを比較するこの試験において、亡くなられた方をすべて調査したものです。つまり再発して乳がんで亡くなった方、それ以外の原因で亡くなられた方すべて調査したものです。
全体ではアリミデックスの群では23.5%、タモキシフェンでは24.0%の方が亡くなりました。
再発して亡くなった方はそれぞれ 12.6%、14.2%ですので、やはりアリミデックスが優れています。
しかしそれ以外で亡くなった方を見ると、それぞれ10.8%、9.8%でタモキシフェンが優れています。
その原因も調査されていますが、”Other cancer” つまり 乳がん以外のがんで亡くなられた方はそれぞれ3.5%と2.6%ですので、タモキシフェンのほうが多いとは言えませんでした。
全体の生死で見たときにはタモキシフェンが圧倒的に劣る、とはやはり言い切れないのです。
このデータは5年間の投与で示されたものです。しかし現在ホルモン治療は、期間が延びており、10年間、あるいはそれ以上、飲まれる方も少なくありません。そうなればより微妙なバランス調整が必要になることが予想されます。60歳の方と70歳の方、80歳の方では人生について、余命についての考え方と、日常生活における”痛み”に対する考え方は異なって当たり前だからです。
「先生、膝が痛くって痛くって…整形外科に言ったら骨粗鬆と言われて薬が出ました。痛み止めも出してもらっています。」
「いやでも、ちょっとでも再発しないほうがいいに決まっていますからね。」
これを60歳の方にも、70歳の人にも、80歳の人にも全く同じように説明していたら、やはり木を見て森を見ず、病を見て人を見ず、ではないでしょうか。メリットデメリットを説明して選択するのは、患者さんの意見も聞いてからのことと考えます。

こうしたことが示していることは、すべての患者さんに、共通して同じように同じ治療が最善とは限らないということです。当たり前といえば当たり前で、そのためにわれわれ”主治医”が存在しています。
患者さんには、だれだれさんはアロマターゼ阻害剤を飲んでいるのに、なぜ私はタモキシフェンなのですか?という疑問を持たれる方がいます。ここではそれに対して答えになる一つの根拠を示しました。
抗がん剤はほぼすべての乳がん患者さんに再発抑制効果があります。抑制効果が0、ということはまずありません。ではすべての方に抗がん剤を勧めるか、答えはNoです。効果だけから判断するものではないからです。すべての治療、薬にはメリットデメリットのバランスがあります。そしてそこにAIではなく人間が主治医である意義があると思っています。
疑問を持ってはいけないのではありません。そこに主治医がその患者さんを診て、選択した理由と、医師としての意思が存在していることを知っておいてほしいのです。
尋ねてみてください。きっと答えてくださると思います。
参考文献
1. Cuzick J, Sestak I, Baum M, Buzdar A, Howell A, Dowsett M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial. Lancet Oncol. 2010;11(12):1135-41.
2. Early Breast Cancer Trialists' Collaborative G. Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet. 2015;386(10001):1341-52.
3. Regan MM, Neven P, Giobbie-Hurder A, Goldhirsch A, Ejlertsen B, Mauriac L, et al. Assessment of letrozole and tamoxifen alone and in sequence for postmenopausal women with steroid hormone receptor-positive breast cancer: the BIG 1-98 randomised clinical trial at 8.1 years median follow-up. Lancet Oncol. 2011;12(12):1101-8.
2021.09.28
乳がん術後にホルモン剤を飲まれている方は多いと思います。
乳がん患者さんの6から7割の方が飲用されているでしょう。
先の第2回で、ホルモン剤には大きく分類して、SERMと呼ばれるタモキシフェンやトレミフェンと、アロマターゼ阻害剤(AI)と呼ばれるアリミデックス、アロマシン、フェマーラがあることはすでに述べました。これらはどう使い分けられているのか、ここで考えてみたいと思います。
まず第2回で、閉経後にはタモキシフェンも、AIも効果がある。
閉経前ではAIは効果がない説明をしました。
そこで使い分けで悩むのは閉経後の乳がん患者さんになります。
卵巣機能を抑制するLH-RHと呼ばれるゾラデックス、リュープリン(注射薬)があります。
原則として上記2種の薬の補助として使われています。LH-RHは視床下部に働きかけて、閉経状態を作り出す薬です。したがって閉経前の方、あるいは閉経が確定していない方に使って閉経状態とするために使います。閉経前の方もLH-RHを使用すれば閉経後と同じ状況になるわけです。
特殊な場合を除いて単独で使われることは少なく、SERM、あるいはAIを同時に使います。
LH-RHを使っておられれば、閉経前であってもSERMとAIの使い分けに関して悩むことになります。
患者さんの中には、閉経前がタモキシフェンなどSERM、閉経後はアリミデックスなどAIと単純に覚えられている方も多いようですが、ここまで読むとそうではないこともわかっていただけたと思います。閉経前であってもLH-RHの併用下にAIを使うことがあり、閉経後であってもSERMを使うことがあるからです。
ただアストラゼネカ社のHPからアリミデックスの薬剤情報を確認すると、この薬剤は”閉経後乳癌”が適応である、とはっきり記載されています。閉経前にAIを使う場合はなにか理由があるから、であることもそこからわかります。通常であれば保険も通らない使い方になるのです。
第2回で述べたように、AIは原則として閉経後の乳がん患者にしか効果を期待できません。
60歳以上の方であればほぼ閉経していると考えていいのですが、50歳前後の方ではまだ不安定であり、閉経しているかどうか確定していないことがあります。婦人科に行けば簡単に調べられますが、そうしない限り50-60歳まではあいまいなことが普通です。AIはその薬剤としての性質上、卵巣でエストロゲン(女性ホルモン)が作られていると、それを抑制できないので、効果が期待できなくなります。SERMは閉経の有無を問いませんので、考慮する必要はありません。その点では有利です。つまりSERM、AIを単独(LH-RHを使わずに)使用するのであれば、60歳まではSERMを使っておけば間違いはないのです。
もっといえば60歳以上、閉経後であってもSERMは効くので、あえてAIを使用しなくてもいいのです(下記の図を参照)。
AIを使うには、あえて使う理由がある、からなのです。

日本乳がん学会が提案している診療ガイドラインにはどのように記載しているでしょうか。
引用します 下記のように記載されています。
閉経後の乳がん患者さんへのホルモン剤治療に関して
特殊な記載方法なので、%って何?と思われるかもしれません。
10/12とは、12人の専門医のうち、ほぼ全員が賛成なのがAIであって、タモキシフェンを使う人は10人程度でしょう、ということです。
弱く推奨する、これまた微妙です。どちらを使っても間違いではない、でも原則AIだよ、と書いている、と解釈してください。いったんタモキシフェンで始めたとしても最終的にはAIを使え、とも書いてあります。逆に、AIで2年治療したらタモキシフェンに変更しろ、ともかいています。
これでは一般の方ではまずどうしたらいいかわからないでしょう。
このガイドラインでは、この根拠となった臨床試験(論文)を2つ挙げています。BIG-1とATACという2つの有名な臨床試験になります。AIはタモキシフェンの後に開発された薬剤です。そこでそれまでに確固たる成績を気づいていたタモキシフェン、つまり標準治療だったタモキシフェンと比較して、どちらが優れているのか、大規模な臨床試験が行われました。将来の標準治療を決める試験をフェーズIIIと呼びます。これはその代表的なものです。
この2つの臨床試験は、閉経後乳がん患者さんを4000人近く集めて、2つに分け、1つのグループはタモキシフェンで治療し、もう一つのグループはAIで治療しました。そしてAIのほうが”有意に”優れているという結果が出たのです。それを今から提示します。(この”有意に”のフレーズが重要です。第1回を参考に)
ただ、ここで注意しておいてほしいのは、それだとガイドラインでタモキシフェンを推奨する先生が0でもいいですよね。8割の先生がタモキシフェンでもいい、としている。問題はそこにあります。AIが優れているなら、タモキシフェンは使うべきではありません。命がかかっているがん治療において、常に最善が標準治療です。このコラムが最終的に説明したいことはそこになります。
そのことを念頭において、とにかくAIがタモキシフェンよりどれくらい優れていたのかを見てみたいと思います。

まずはBIG1トライアルの結果からです(Regan MM: Lancet Oncol. 2011;12(12):1101-8.)
グラフは開始すぐから離れ始めて、きれいに分かれてしまっています。このグラフは最初は100%の患者さんが再発無しに生存されていた。しかし時がたつにつれ、再発や、また乳がんになったりすることで健康な方は減っていきます。10年経過して最終的には70%前後まで落ち込んでしまう、それを表しています。そして最後まで青線、つまりフェマーラを使用していた方が、赤線、タモキシフェンを使用した方を上回りました。
グラフの中ほどに”HR 0.82”と記載があることに注目してください。
これは、フェマーラはタモキシフェンと比較して乳がんの再発を18%さらに抑えた、つまりタモキシフェンで再発する方を100とすれば、フェマーラでは82になる、という意味になります。
アリミデックスとタモキシフェンを比較したATAC試験もほぼ同様の結果でしたので、グラフは示さずに”HR 0.86”のみ示します(Cuzick J: Lancet Oncol. 2010;11(12):1135-41.)
この結果からはどう考えても、タモキシフェンよりもAIの一択です。
もちろん閉経前の方であっても、LH-RHを併用してAIを使用しておくことで、再発予防がより期待できる。
それでもなぜ医師の8割はタモキシフェン使用を認めているのか?
実際タモキシフェンを飲んでおられる方も多いはずですよね。特に閉経前の方ではそのはずです。
長くなりました。まだまだ続きます。
2021.08.23
女性ホルモンの働きをブロックすることで、乳がん細胞の分裂を抑制する、あるいは止める。
この考え方に間違いはありません。乳がん細胞の中には女性ホルモンに”依存”しているものがおり、女性ホルモンが枯渇すると増殖を止めてしまうものがいます。乳がん患者さんのほぼ6割以上がそうであるとされており、女性ホルモンを抑えるための薬を飲んでおられるのはそのためです。
注射で行われる薬を除けば、その薬は大きく二つに分類されます。
SERMと呼ばれるタモキシフェンと、
アロマターゼ阻害剤と呼ばれるアリミデックス、アロマシン、フェマーラ(この3種類のうちどれかを飲まれていると思います)です。
ここでSERMですが、初めて聞かれた方も多いでしょう。”選択的エストロゲン受容体調整薬”の略語です。SERMでネット検索をすると、しかしタモキシフェンもヒットしますが、同時に骨粗鬆の治療薬がヒットします。このことで分かるようにエストロゲンは骨に関係が深く、エストロゲンの働きを抑えれば骨はもろくなり、刺激することで骨は丈夫になります。(ここではきわめて簡単に言ってしまっていますが、その機構はもっと複雑です。)ここで矛盾に気が付かれた方も多いはずです。タモキシフェンは女性ホルモンの働きをブロックするはずですが、骨に対しては女性ホルモンのようにふるまうのです。したがってむしろ骨は丈夫になる働きをします。
ではアロマターゼ阻害剤では骨は丈夫になるでしょうか?
いえ、アロマターゼ阻害剤では骨はもろくなり、骨粗鬆が進みます。
なぜそのような違いが生じるのでしょうか?

上の絵を見てください。
女性ホルモンをカギに、そしてそのホルモンの信号を受け取る”レセプターを鍵穴に例えました。
女性ホルモンは共通ですが、鍵穴のほうが骨、子宮のものと、乳腺のものでは微妙に異なっているのです。女性ホルモン(エストロゲン)は両方を開けることができます。鍵が開くと、刺激がそれぞれの臓器を構成する細胞に入り、増殖が始まります。
SERM、ここではタモキシフェンは大変特殊な働きをします。女性ホルモンに似ていますが、微妙に異なる鍵であるため、骨や子宮の錠前は開けることができるのですが、乳腺の錠前には刺さったきり、開けることができません。この刺さるけれども開かないところがミソなのです。
エストロゲンがやってきても、タモキシフェンが鍵穴を塞いでいるので、乳腺の錠は開かないのです。タモキシフェンは女性ホルモンの1000倍以上の強さをもって乳腺の鍵穴に引っ付いてしまって、これをエストロゲンからブロックしてしまうのです。
ではアロマターゼ阻害剤はどうなのでしょうか。
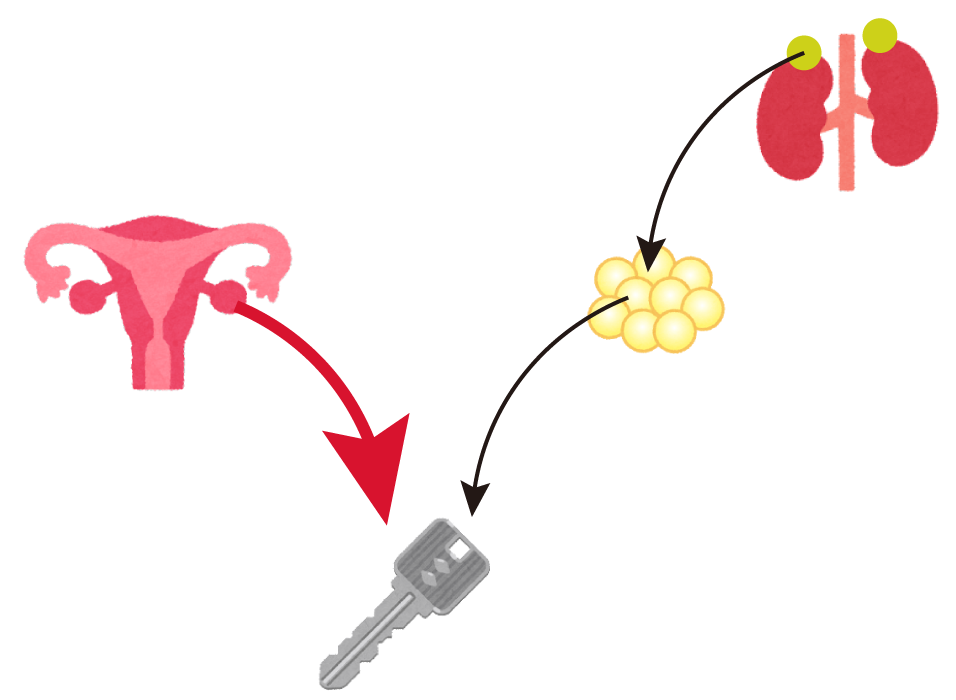
上の絵を参考にしながら読んでください。
女性ホルモン、この場合エストロゲン、は主に卵巣で作られます。若い女性(閉経前女性)では、この卵巣で作られるエストロゲンの働きによって、性徴がおこり、女性として体がつくられ、排卵し、妊娠し、子供を授かることができるようになります。
閉経後は、この卵巣からのエストロゲンの供給がほぼなくなりますが、それによって女性ホルモンが0になってしまうのか、と言えばそうではありません。副腎という腎臓の上のところに存在している小さな臓器が男性ホルモンをつくっており、それが脂肪細胞によって女性ホルモンに変換されます。これによってわずかですが、エストロゲンが体には供給されているのです。もちろんこれは男性にも起こりますので、男性にも女性ホルモンは流れています。量がわずかなだけ、はるかに男性ホルモンが多いだけです。
脂肪細胞に存在し、男性ホルモンから女性ホルモンを作り出す物質がアロマターゼであり、これをアロマターゼ阻害剤はブロックするのです。
これによって閉経後にわずかに供給されていた最後の命脈を絶たれたエストロゲンは、体の中で文字通り”枯渇”します。タモキシフェンとはレベルの違う女性ホルモンの抑制が起こるのです。骨も、子宮も、乳腺も、エストロゲンが枯渇しているわけですから、刺激が一切来なくなります。
ただ注意が必要なのは、アロマターゼ阻害剤は、脂肪細胞におけるアロマターゼの働きを阻害しますが、卵巣は抑制しません。そのため、閉経していない、つまり卵巣が働いていれば、全く効果がありません。
逆にタモキシフェンは女性ホルモンが卵巣から供給されようが、脂肪細胞から供給されようが、そもそも鍵穴自体がふさがっているので、ブロックできるのです。
したがってアロマターゼ阻害剤は閉経後、それも間違いなく閉経していることが条件となります。
そしてタモキシフェンは閉経前であっても、閉経後であっても、効果はあるのです。
なるほど、たしかに閉経前がタモキシフェン、閉経後がアロマターゼ阻害剤、という風に単純にいかないことはわかった。でも、それだと逆にタモキシフェン一択でいいのではないか?
なぜ閉経後はアロマターゼ阻害剤を使われることが多いのか?
それを次回に触れていきましょう。
2021.08.17
この話の最初はこの質問から始めます。
「1000人の生徒を抱える塾がA、Bと二つあります。Aの塾では499人が東大に受かります。Bでは500人です。わずかな差ですが、10年間の平均の成績から明らかにBの塾のほうが優れていることがわかっています。しかしAの塾は毎月1万円、Bの塾は100万円の授業料がかかります。皆さんは子供をどちらの塾に入れますか?」
最初から難しい話で申し訳ない。
ホルモン剤はそもそもなぜ飲まなければならないのか?
これがわかっておられないまま飲まれても10年どころか5年飲むことも苦痛でしょう。
がんだからでしょう? そのとおり。
でもホルモン剤はがんに対してどうしてくれるというのでしょう?
治してくれる。 それは当たり前ですけれどもね。


ホルモン剤に限らず、抗がん剤にせよ、分子標的薬剤にせよ、もちろんがん治療を目的に作られていますが、製薬会社にとってはそれ以上に重要な目的があります。こうした薬剤の開発費は膨大なものとなっており、その回収をしなければ、社員の給料どころか、会社の存続すら危うくなります。投資した分は回収し、さらに次の薬剤の開発費も稼がなければやっていけません。効果は大きく見せたいですし、副作用は小さく見せたい。その上で現在使用されている標準治療の薬剤を“有意に”上回る成績であれば、最上級の成果になるでしょう。
“有意な”というのは統計学的に意味がある、ということになります。
サイコロゲームを考えましょう。1-3の目が出ればあなたの勝ち、4-6が出れば私の勝ちです。お気づきですが、このゲームは繰り返せば繰り返すほど、回数を増やせば引き分けになります。ですので、最初の3回連続で貴方が勝った、としても、だから貴方はこのゲームにおいて私よりも強い、と結論付けるのは間違いです。
ただ回数を何回くらいまで増やしたら大体引き分けになってくるか、それが問題です。1回だと絶対に引き分けはありませんよね。最低6回は必要そうです。
このサイコロを100の目のサイコロとします。たとえば1が出れば貴方が勝ち、2から100までなら私が勝ち、その勝負をする人はいません。1から49なら貴方、50から100なら私、これも実は私が勝ちですが、その差がわずかしかないので、おそらく6回勝負したくらいでは結論は出にくい。貴方と私の勝率がきちんと49:51になるのには相当な数の勝負をしないといけないと思います。
逆にわずかな差しかなくても、それに対応するだけの千回、一万回、十万回と多くの回数の勝負をしたら、その差は統計的に“有意な”ものだ、と結論付けることが可能になります。巨額の投資を行い、1000人、1万人といったたくさんの患者さんで臨床試験をすれば、わずかな差しかない薬剤であっても有意差をもって優れている、という結果を出すことができます。
ながなが話をしてきましたが、こうして証明された“有意に”優れた治療法が、論文になっていたとしても、それはたしかに優れているかもしれないが、実際にその治療法を受けられる患者さんにとって意味があることなのかはしっかり見定めないといけません。
「え、どんなに小さな差であっても、わずかで優れている治療法がいいんじゃないの?」
そう思われる方もおられるでしょう。たしかに、学問として考えればそうです。 ただわずかに治療成績が優れているから、それが第一選択の治療法、つまり標準治療になり得るのか、を考えたいのです。
たとえば1000人の生徒を抱える塾がA、Bと二つあります。Aの塾では499人が東大に受かります。Bでは500人です。わずかな差ですが、10年間の平均の成績から明らかにBの塾のほうが優れていることがわかっています。しかしAの塾は毎月1万円、Bの塾は100万円の授業料がかかります。皆さんは子供をどちらの塾に入れますか?
そういうことです。何事もバランスなのです。
たくさんの患者さんを集めて研究すれば、わずかな差であっても優劣を統計学的に証明することができます。Bの塾はその結果を踏まえてAの塾を研究するでしょう。AもBの欠点を研究するかもしれない。それはそれで意味はあります。しかし実際に子供を塾に通わせる親にとっては、その程度の微小な差で、それだけの費用を負担させられるのは受け入れられません。
最初の薬の話に戻ります。
新薬が開発されたとして、その巨額の開発費を製薬会社は何としても回収したい。そのためには標準治療に何としても勝ちたい、その可能性も高そうです。しかし標準治療は歴戦の勝者、それほどの差は望めません。
そこで10000人の患者さんを集めて臨床試験を行い、標準治療では4999、新規薬剤では5000の人が治りました。統計的にも新規薬剤が優れていることが”有意に”証明されたとしましょう。
こうして出てきたお薬は“いままでの標準治療よりも優れていることが証明されています”と打ち出し、販売されるでしょう。当然開発費が上乗せされ、特許が乗り、大変高額なものとなるはずです。宣伝費も含まれます。一方で標準治療はすでに特許が切れ、ジェネリックに置き換わっており、安価になっています。
さあどちらの治療法で治療するのが正解でしょうか?
副作用はどちらが強いのですか?
その考え方が正解です。それなしで決められませんよね。
治療法を選択するにあたっては、したがって優劣がある場合、優を第一選択にしつつもそれがどれくらいの差なのか、は把握しておく必要があります。そのうえでコスト、副作用はもちろん、通院の手間や、経口薬であり簡単に家で治療できるのか、長時間かけて病院で点滴しなければならないのか、も考える必要があります。そうです、バランスをとること、それが一番大事なのです。
これは大変難しい作業です。加えてその患者さんの事情によって、個別に考えていかないと、結論が出ないことでもあります。そのために主治医が必要であり、コンピュータで治療法を決められない理由にもなるでしょう。


私がたびたび引用している米国臨床腫瘍学会(以下 ASCO)ですが、今年の学会が終了してほぼ2か月経過した今の時期、その学会で発表された大きなデータをもとに、彼らが推奨する標準治療の刷新を発表します。
標準治療とは、日本の”標準”という意味合いと少し異なっていて、”王道”というほうが近いかもしれません。がんの治療は命がかかっていますので、松竹梅で決められてはかないません。最善は一つ、よって王道も一つ、それが標準治療です。(ただし現状、どちらが優れているか決められない時は2-3つの選択肢が提示されていることもあります)
ASCOが標準治療として定めるガイドラインが改定される、その際にはかれらはその新しい項目をピックアップして発表します。変更のないところはあえてもう一度発表しなおす必要はありません。なのでその発表を読めば、今年どんな新しい治療が開発されたのか、そしてその治療はいままでの王道とされてきた治療を塗り替えるものだったのか、あるいは今までにない新しいバイオマーカー(指標となる検査結果、それによって最善の治療方法が変化する)が出てきているのか、一気にまとめて知ることができるのです。(なんて便利なのでしょう。)
先日も”FACEBOOK”にてASCOから発表がありました。
ちなみに乳がんだけではありません。様々な臓器のがん、大腸がんや膵がん、様々に進行したがん、早期がんや、進行がん、転移性のがんなど、それぞれについて今年の最新のデータを基にしたガイドラインの改定が、別々にまとめられ発表されていきます。さまざまな先生方が集まって、今年の新しい発表に他の学会の発表や論文も加えて、話し合いを重ね、できるだけシンプルに整理して発表されていく、そんな感じです。(ああ、本当になんて便利なのでしょう。)

2CDK4/6阻害剤は、閉経後女性に対してはノンステロイダルなアロマターゼ阻害剤(筆者注:日本ではアリミデックス®、フェマーラ®がそれに相当する)との併用を勧め、閉経前女性に対しては何らかの卵巣機能抑制(外科的に卵巣を摘出することを除けば、ゾラデックス®や、リュープリン®などのLH-RH製剤を使用する)を行った上で、それらを行うことを推奨する。
これらが示されました。難しいですね。
この記事に興味を持つ方以外だと、理解は難しいと思います。ただすでにホルモン剤とCDK4/6阻害剤を飲んでおられる方で、さらに効果が弱くなって来られている状態の方だと、不安な日々を送られているでしょうから、こうした記事は理解もでき、興味もあるのではないでしょうか。
つまり先述した状態の方であれば、こう読んでほしいのです。
PIK3CA遺伝子の変異を調べ、その異常が見つかれば、アルペリシブという新薬が効果を示す
これが今年新しく示されたのです。

Andre F, Ciruelos E, Rubovszky G, Campone M, Loibl S, Rugo HS, et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med. 2019;380(20):1929-40.
実際の論文には図のような結果が示されました。
PIK3CA遺伝子変異陽性の腫瘍を持つ再発患者さんが、フルベストランとアルペリシブによる治療を受けられた場合、フルベストラント単独と比較して、5.7か月から11.0か月も進行を遅らせることがわかりました。たった5か月程度と思われるかもしれませんが、ほぼ倍に伸びています。それから言えば1年で進行する方なら2年に延びる可能性がある、と考えると非常に良好な結果であるといえます。
ただ同時に行われたPIK3CA遺伝子変異のない方での検討では残念ながら差が認められませんでした。
3でも示されているように、PIK3CAというバイオマーカーを参考にして、それが陽性であればアルペリシブが効果があります。
また以前紹介したようにBRCAというバイオマーカーを参考として、それが陽性であればPARP阻害剤、具体的には日本ではリムパーザが効果があります。
以前はホルモンレセプター(HR)、あるいはHER2、この二つが代表的なバイオマーカーでしたが、今ではこれに加えてPIK3CA、BRCA、さらに免疫チェックポイント阻害剤のバイオマーカーであるPD-L1が加わったことになります。単純にHR陽性陰性で2、HER2の陽性陰性で2、と2の5乗、32種類のがんが分類されたことになり、治療も応じて複雑化してきています。将来は次世代シーケンサーで一気にバイオマーカーを検査して、適切な治療法をAIが提示してくれる、そんな風になりそうです。
現在、日本で保険適応とされているのは2だけになります。
3は一部で可能になっています。ただ文面からはPIK3CA変異の検査はルーティンとして施行するべきと書かれていますが、日本では保険収載されていません。またこれが可能になっても、それに対応する治療薬剤のアルペリシブが保険収載されていないため、もうしばらく待たないといけません。
またアルペリシブによって高頻度(3割以上で比較的重症になるとされます)に認められる耐糖能異常のコントロールについても、実際の使用に際しては、発生したときに対応をどうするか、しっかり対策を立てておく必要があるでしょう。
ただこうした道筋が見えていれば、何もない暗闇で待つよりも光が見えています。COVIDのワクチンで分かるように、必要とあれば数か月で臨床導入されるのですから、あきらめるのは早いと思います。
朗報を待ちましょう。
この記事は、BRCA遺伝子変異を有する、と診断された乳がん患者さん向けに書かれたものです。とくにトリプルネガティブ乳がんの方には関心のある話題となるでしょう。しかしそうでない方には難解な内容が含まれます。興味のある方はこのサイトを参考にしてください。(遺伝性乳がん卵巣がん症候群(HBOC)をご理解いただくために)
今年も米国シカゴにて、世界最大といっても過言ではない臨床腫瘍学会、がんの基礎研究ではなく、臨床の実践における研究の発表の場であるASCOが開催されています。
乳がん分野における注目に値する最新の研究結果を患者さんにわかりやすく提示できればと思っています。特に本年ではプレナリーセッションと呼ばれる、”絶対に知らなければならない、無視はできない”と学会本部が認めた今年最も重要な研究結果の発表の中に乳がんに関するものがありました。それはBRCA遺伝子変異のある方(アンジェリーナジョリーで有名になりました)が、進行した乳がんで発見された場合、オラパリブ(商品名 リムパーザ🄬)を再発予防の目的で、1年間飲んでおけばどのような影響があるか、本当に再発はすくなくなるのか、にこたえる研究結果です。
ちなみに現在オラパリブは再発乳がんの治療に使用され、すでに大きな成果が上がっています(私が以前書いた記事を参考にして下さい。”Triple Negative乳ガンの新しい薬剤”)それならば再発をしないように、再発される可能性の高い方に、再発する前から使用しておけば、再発そのものをしないようにできるのではないか、目に見えない転移の段階で使えば、撲滅できるのではないか、という疑問に答える研究です。
ただもちろんその中にはもともと飲まなくても再発しない方、手術で完全に治っておられる方も含まれます。そのため、それによって大きな副作用があってはなりません。生活に与える影響や副作用を含めた安全性も同時に慎重に調査されました。合計で1836名の患者さんを、予防的にオラパリブを飲む群と、プラセボ(偽薬)を飲む群にランダムに分け、予後を追跡したのです。このようにすると、患者さんも医師も、その患者さんがどちらに振り分けられているかわからないため、さまざまなバイアス(予後に与える影響)を排除し、より精度の高い純粋な結果を得ることができます。こうして完璧に準備された研究で、疑いようのない、決定的な結果が得られました。

小さい絵に情報を盛り込んだため、専門用語を使わざるを得ませんでした。上記はフローチャートと言われるもので左から右に見ます。こうした方たちを〇で囲んだところで1:1に分けて片方にオラパリブ、片方に偽薬を投与した、ということを略図を使って表現しているものです。試験のデザインですので基本となる重要なものです。
Germline:がんの部分に遺伝子異常があるのではなく、生来の異常がある方
HR:ホルモンレセプター(これがある方にはホルモン治療を行う)
non-PCR:術前化学治療をしてもがんが消えなかったという意味です。
今回の試験の対象とされたのは、まず遺伝性の異常(BRCA)を有している方で、HER2陰性で、化学治療を必要とされる比較的進行した乳がんの方、であることが示されています。現在は手術前に抗がん剤される方もおられます。もしそれでがんが消えてしまえば予後がいいことが知られています。それでもがんが残ってしまった方が試験の対象とされました。
NAC:術前化学治療
RCT:ランダム化前向き試験
PrimaryとSecondary:この試験で確認したい最大の課題、と、副次的に証明される課題
CPS+EG Score:これは彼らの独自の分類で、乳がんにおける病期(早期、末期など、数が大きければ進行がんで、かつ予後不良となる)
この試験では最終的に 平均年齢は42-3歳の方が参加されました。
BRCA1異常の方が70%前後、BRCA2異常の方が30%前後でした。
最終的にホルモンレセプター陽性の方が2割程度、8割の方がトリプルネガティブとよばれるホルモンレセプター陰性でした。HER2陽性の方は慎重に除外されています。
術前に抗がん剤を受けられた方、術後に抗がん剤を受けられた方が半々でした(この試験は、もともと抗がん剤の適応があるような進行したがんの方が対象ですので、参加された全員が何らかの抗がん剤投与を受けられています)。
結果です。
3年間追跡して調査したところ、再発は104例→65例に抑えることに成功しています。ハザードというのですが、0.61(99.5%信頼区間として0.39~0.95)と示されました。それは本来100でおこる再発を61にまで抑える、という素晴らしい成績だったのです。
遠隔転移(肺や骨、脳、肝臓への転移)はハザード0.57(99.5%信頼区間として0.39~0.83)で抑制されました。
生存率に関しても、ハザード0.68(99.5%信頼区間として0.44~1.05)で死亡される確率が抑制されました。がんの再発や、転移が認められたらもちろん治療をその後に行います。そのため、再発や転移を抑制できても、その後に行われる治療が影響するために、最終的に生存率そのものが改善することは、実は難しいのです。今回は、再発、転移の抑制効果が大きかったために、生存率でみても差があった。文句のつけようがない素晴らしい結果です。
今後 BRCA遺伝子変異が証明された方で、再発の危険性が高いと判断されて、抗がん剤治療を要した方では、その後に予防的にオラパリブを1年間飲用使用しておくことが勧められるでしょう。ただ現時点ではオラパリブを用いた予防的治療は保険収載されていませんが、近い将来には収載される可能性があります。それからはこうした治療が当然のことになる可能性があります。
この傾向はトリプルネガティブ乳がんの方でより強く認められたことも付記しておきます。
続き(この記事は乳がん術後、とくにトリプルネガティブ乳がんについてある程度知識を持っておられる方を対象に書かれているため、一般の方には難解です。また知識がおありの方も、できれば姫路赤十字病院ホームページで私が書いたトリプルネガティブ乳がんの記事を読まれた後で読んでいただくことで理解が深まると思います。)
http://himeji.jrc.or.jp/category/diagnosis/nyusengeka/topics/20170912_1.html
ここまで免疫チェックポイント阻害剤(ICI)がトリプルネガティブ乳がん、それもPD-L1をがん細胞が提示していて、リンパ球の攻撃から逃れている可能性があれば、いままでの抗がん剤のみの治療と比較して、効果があることが証明されたことの話をしてきました。
再発、転移乳がんの治療は、しかし延命治療のニュアンスがあるため、皆さんの中には数か月余命が伸びたところでと思われる方が多いかもしれません。ただ、たとえば手術前後の治癒する可能性が高い患者さんに、こうした新薬を使って万が一でも今までの治療よりも結果が劣ることになれば、そのことはすなわち治癒するべき方を治癒できなくした、ということになります。順序として再発・転移の進行した乳がん患者さんで延命効果が証明された薬剤でなければ、手術前後の治癒を狙った治療には応用されにくいのです。
前置きが長くなりました。
こうしてICIは再発・転移乳がん患者さんの延命効果が証明されました。次は手術前後でこの薬剤を使用して、“治癒率”が上がるかどうかです。今までの治療では5割の方が治癒していた、それがICIを使用することによって6割、7割の方が治癒できるのか。その結果が2020年2月に発表されました。
https://www.nejm.org/doi/pdf/10.1056/NEJMoa1910549?articleTools=true
この試験 KEYNOTE-522では、ステージ2あるいは3の比較的進行したトリプルネガティブ乳がん患者さんをランダムに2:1に分け、従来の化学治療(この試験ではパクリタキセル+カルボプラチン → EC あるいはACです)にICIとしてキィトルーダを加えたもの、そしてプラセボを加えた群に分けました。
注意が必要なのは、この試験は手術前の抗がん剤(Neoadjuvant chemotherapyと言います)として行われ、その後に行われる手術でがん細胞が完全に死滅しているかどうか、その割合の高いのはどちらか、という観点で行われました。
手術前化学治療はほぼ半年間で行われます。手術はその後、時を置かずに施行され、摘出された標本はこれもすぐに病理検査されます。つまり半年あれば一人の方のデータが取れます。
術後 治癒したといえるにはトリプルネガティブ乳がんでは最低3年、通常5年間再発がないことが証明されなければならず、治癒した割合を比較する試験は結果が出るのが遅れてしまうのです(これも将来発表されることはわかっています)。
さてその結果です。
ICI投与群では64.8%の方のがんが消失していました。非投与群では51.2%であり、有意(p<0.001)に投与群で成績が良いことが証明されました。副作用は、先日のデータと変わらず、ICIに特徴的な皮膚の変化、そして甲状腺機能異常、副腎機能異常が認められましたが、投与を中止しなければならないレベルの副作用はまれでした。
この試験ではPD-L1の発現条件を加味せずにエントリーが行われたため、PD-L1の発現の強弱で効果が異なるかどうかは結論が出ませんが、発言が強ければ強いほど、効果が期待できることは簡単に予想できることでしょう。
ついに補助化学治療においても、ICIの効果が証明されました。つまり進行したトリプルネガティブ乳がんを治癒に導くことのできる可能性が、ICIによって今後高まることが示されたと言えます。
今まで乳がんは大きく4つに分けられていました。ルミナールA ルミナールB HER2エンリッチ、そしてトリプルネガティブ乳がんです。この分類がそのがん細胞のもつ標的と、その治療によって分けられていたことは皆さんもご存知の通りです。下の図を見てください。
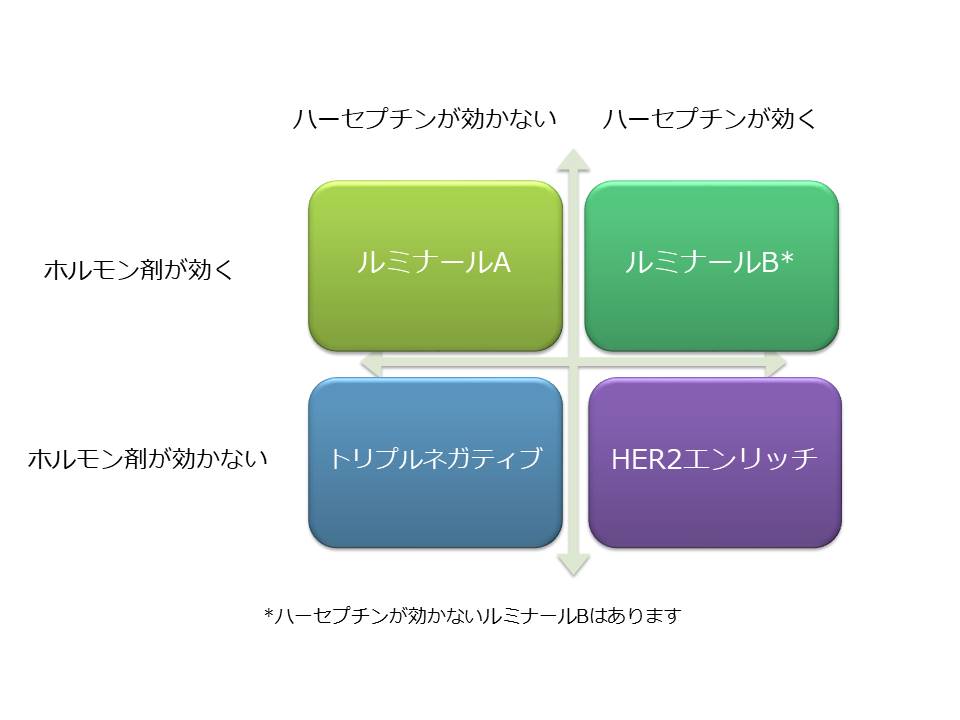
ルミナールBタイプは発言の強弱があってグレーゾーンであり、この4つは実際にはこれほど厳密には分けられない部分もあります。しかしトリプルネガティブ乳がんに関しては、両方とも発現が0であるガン細胞として特徴的です。ホルモン剤も、そしてハーセプチンをはじめとするHER2への標的薬剤も効果が期待できず、抗がん剤に関しても使用してみないと効果はわからないのが原則でした。
しかし以前 姫路赤十字病院のホームページでお話ししたPARP阻害剤(現在リムパーザ®が保険適応になっています)に関しての効く、効かない、そしてそれに加えてICIの効く、効かない、が加わったため、これからはトリプルネガティブ乳がんも4つに分けられることが明らかです。(下の図を参照してください)
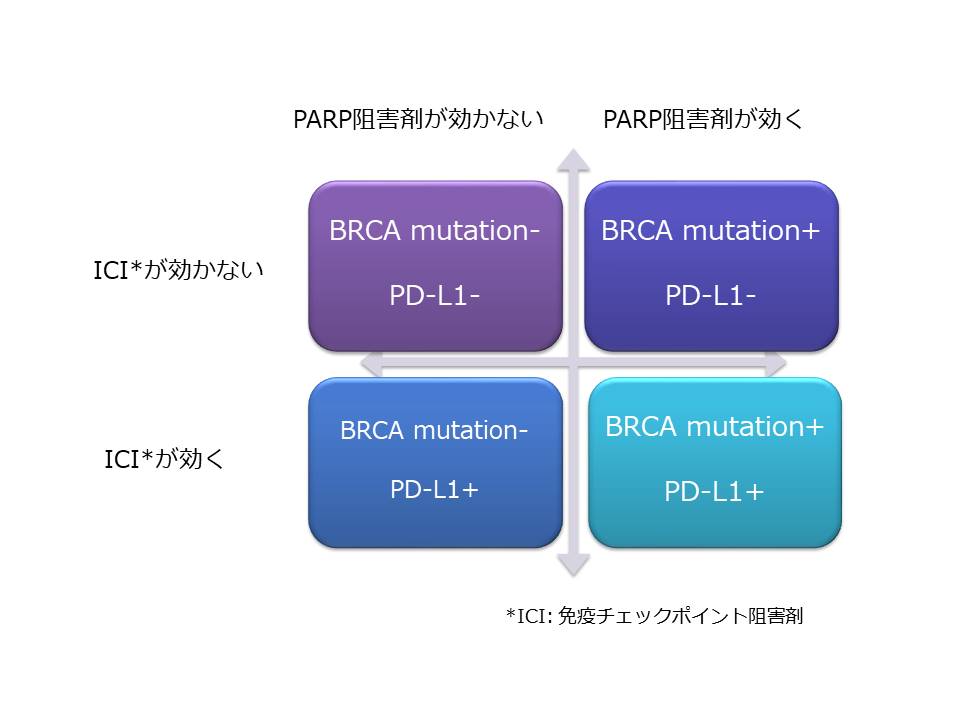
以前書いた6つの分類とは異なる分類ですが、おそらくBRCA mutation+ PD-L1-はBasal like 1タイプのトリプルネガティブ乳がんに、BRCA mutation- PD-L1+はIMタイプのトリプルネガティブ乳がんに相当すると考えられます。そして以前お話ししたとおり、トリプルネガティブ乳がんの6つの分類は、研究室のみで可能な話でしたし、現状はその域を出ていませんが、この4つの分類は今の日本の保険適応の検査でも分類可能です。つまりもはや実践段階なのです。
BRCA mutation- PD-L1-のトリプルネガティブ乳がんのなかのトリプルネガティブ乳がんについても、もちろん研究と治療の開発が進んでいます。6つの分類のうちに薬が揃っていないPI3K阻害剤はすでにたくさんの薬が開発済みで試験が始まっています。
憎きトリプルネガティブ乳がんの包囲網は狭まりつつある、そういえるようになってきています。皆さんの治療に役立つ段階なのです。始まりの終わり、黎明期は終わりました。つかみどころのないトリプルネガティブ乳がん、のイメージは変わりつつあります。これからは実践投入の中でさまざまな喜びと、そして学びの中から更なる課題が出てくるでしょう。
以前 私が勤務していた姫路赤十字病院のホームページでは、乳がんに関していくつか記事を書かせていただいていました。幸いご好評いただき、たくさんのアクセスを頂いた記事もあります。その中でTriple negative(トリプルネガティブ)乳がんの記事は飛びぬけてアクセス数が伸びており、関心の高さを感じさせていただいたとともに、このがんで苦しんでおられる患者さんの多いこともまた実感として感じていました(http://himeji.jrc.or.jp/category/diagnosis/nyusengeka/topics/20170912_3.html)。
その記事の中で“トリプルネガティブ乳がんは一種類ではない”ということを述べました。大きく6つに分けられており、それぞれに対応する治療法もまた開発が進んでいると述べました。6種類のタイプ分けはがんの遺伝子の解析から導き出されたものであり、研究段階であるため、いま病院で治療中の方にはまだまだ応用できるもの、できないものがあります。2021年現在、DNAプロファイリングと呼ばれる手法が、実地臨床にも導入されつつありますが、それでもそれによってきれいに6つに分類できるものではなく、もちろん対応するとされる治療法もそのタイプであれば必ず効いたり、それ以外のタイプには全く効かなかったりするものではありません。トリプルネガティブ乳がんという、特徴のないことが特徴のがんに対して、すこしでも特徴を見つけ、タイプ分けできれば理解が進み、治療の標的を決めやすくなることから、仮にそのように分類された、と考えておいた方がよいでしょう。
さてその記事の中で、IMとされた分類、別名 髄様がん(Medullary breast cancer)について述べました。この種類のトリプルネガティブ乳がんの腫瘍部分を顕微鏡で観察すると、腫瘍浸潤リンパ球(TIL)と呼ばれるがんをやっつけようと集まってくるリンパ球がたくさん観察されます。私たちの体に備わっている免疫細胞が戦ってくれているので、もともとトリプルネガティブ乳がんの中では予後が良いことが知られていました。
ただがんとして、しっかり成立しているのだから、このがん細胞はこうして集まってきているリンパ球を無力化する力を持っていることもわかります。まして転移再発を来してどんどん病状が進んでいればなおさらです。
最近、この働きをつかさどるPD-1、PD-L1と呼ばれるシステムが見つかりました。京都大学特別教授の本庶佑先生が発見したたこの免疫の監視から“逃げる”機能の発見は、のちに様々な方法で“逃がさない”方法を開発することにつながり、がんの治療、特に肺がんの治療方法を画期的、かつ完全に書き換えてしまいました。この功績によって本庶先生は2018年のノーベル賞を受賞されています。

このシステムをわかりやすく描くと上の図のようになります。がん細胞をやっつけようと集まってきたリンパ球に、がん細胞はPD-L1を使って賄賂を渡し、お目こぼしを図る。リンパ球がPD-1でそれを受け取ってしまうと、集まってきても何もしなくなり、攻撃をやめてしまうのです。この賄賂のやり取りの現場は免疫チェックポイントと呼ばれています。免疫チェックポイント阻害剤(ICI)と呼ばれる薬剤はこの現場をブロックしてしまいます。これによってがん細胞をやっつけに来た免疫細胞が本来の役割を取り戻し、攻撃を始めます。これにより、抗がん剤に強い抵抗性を持つがん細胞を破壊することが可能になり、いままで難治とされたがんの治療にも大きな成果が上がっています。
乳がんもその例にもれず、少しずつこのICIが効果を上げるものが見つかってきました。
その一つが先に述べたトリプルネガティブ乳がん、髄様がんであり、またその分類に属さないタイプの乳がんであっても、そのがん細胞が細胞表面にPD-L1を多く表出しているものではICIが効果を発揮することがわかってきました。
2020年米国臨床腫瘍学会(ASCO)で発表され、12月にLansetで論文発表されたKEYNOTE-355は転移性のトリプルネガティブ乳がんに対するICIの効果を証明したものとして大きな話題になりました。(https://www.thelancet.com/action/showPdf?pii=S0140-6736%2820%2932531-9)
この試験ではPembrolizumab(日本名 キイトルーダ)というICIを使用します。
再発・転移を抱えるトリプルネガティブ乳がん患者さんを治療するにあたって、医師が選んだ抗がん剤のみ(プラセボを上乗せ)で治療する群と、抗がん剤に加えてキイトルーダを上乗せする群に分けて、効果(どれくらいの期間進行を抑えることができるのか?)、そして副作用の内容や出現率を比較しました。
まず、PD-L1を強く表出している群、そして弱いけれどもわずかでも表出している群、そしてしていない群に分けます。その上でそれぞれの群をランダムにキイトルーダを使用する群と使用しない群に振り分けたのです。ここでは髄様がんかどうかではありません。がん細胞がPD-L1を出しているかどうか、が問題でした。
下のグラフは、強くPD-L1を表出していたトリプルネガティブ乳がんに対するキイトルーダの上乗せ効果を示した結果です。
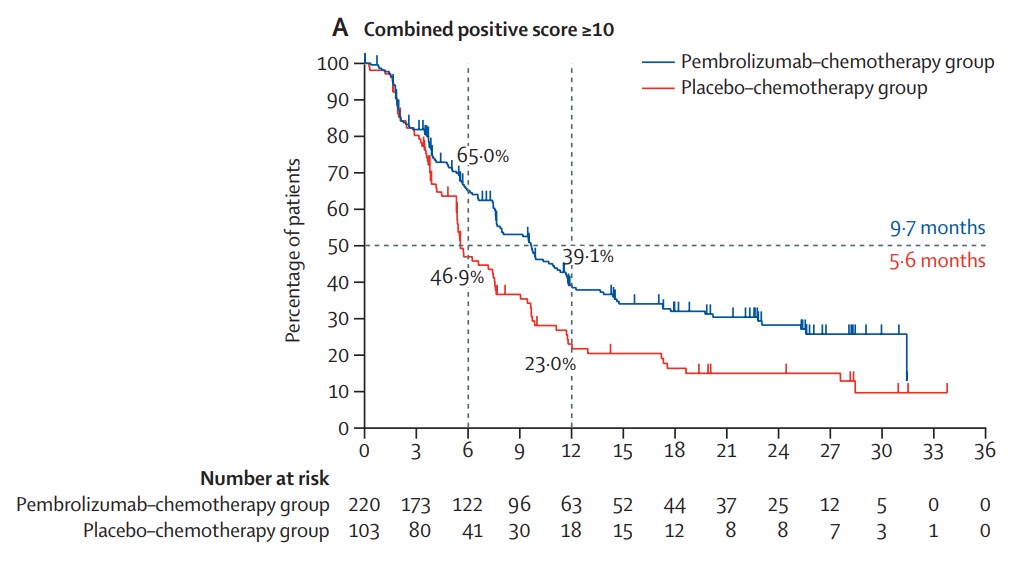
このグラフの見方は、50%の患者さんで進行を4.1か月遅らせることに成功した、と読みます。青色の線は常に赤の上にあり、治療期間全体にわたって、キイトルーダを併用した群はしなかった群よりもがんの進行が抑制されました。
治るのではないのか、たかが4か月なのか、とわずかな効果に見えるかもしれませんが、キイトルーダなしで化学治療を行った場合、つまり今まで通りの治療であれば、50%の方は5.6か月で再び進行が始まることが示されています。キイトルーダはそれを9.7か月と倍に伸ばしたことになります。その計算倍率からすれば、今までの治療で1年間有効であった方はそれが2年に延びます。素晴らしい結果だったのです。
一方で副作用はどうでしょう。いままでさまざまな“サプリメント”が“免疫を改善する”、”免疫を増強する”と歌って発売されました。先日もある患者さんと、そういえば水素水も免疫がどうしたこうしたと言われていましたね、と話をしました。免疫の難しいところは、上がったにせよ、下がったにせよ、その機能を測定できない、ところにあります。たしかに白血球が少なくなれば免疫が落ちている可能性がありますが、それも免疫がまったく正常の方でもなんらかの感染がなければ低い数値になっていることはよくあります。逆に感染症を起こして高熱にうなされ、重症になっていれば白血球は上昇していますが、そもそも感染を起こしているのですから、免疫がしっかり働いて、などと感じないはずです。
副作用から見たとき、このICIの恐ろしいところは、がん細胞が免疫から逃げるために使っているPD-L1という分子は、正常細胞も必要な時に使う大切な機能のひとつである、そこを阻害してしまう、ということです。つまりICIが働けば、免疫細胞はがん細胞の攻撃を始めるだけではなく、それを使って免疫から攻撃されないようにしている正常な細胞も攻撃を始めるのです。
キイトルーダを使用したこの試験でのその代表が甲状腺機能低下、あるいは亢進です。橋本病(甲状腺機能低下)、バセドウ病(甲状腺機能亢進)はいずれも免疫の異常によって引き起こされます。これがICIによって引き起こされるのです。それ以外にも、ICIには抗がん剤では見られない特徴的な副作用があることがわかってきています。アトピーに似た皮膚の炎症はよく見られる合併症です。副腎機能異常、心筋炎といった重篤な副作用も報告されています。
ICIを使って治療を行っている医師の間では、免疫のお薬だから、効果は高く、副作用は軽い、だから抗がん剤よりも気楽に使える、と考えるのは早計だということがもうわかっています。ただいままで抗がん剤で治療してきても効果が今一つ得られなかったがん患者さんには、選択肢が確実に増え、朗報であることは間違いありません。
長くなりましたので、次回と2回に分けて、トリプルネガティブ乳がんと免疫チェックポイント阻害剤について、さらに解説していきます。
4月27日 国立がん研究センターが、2008年にがんと診断された人の10年後の生存率を発表しました。といってもこれまでも発表はなされてきたので、最新のデータに更新されたというのが本当です。各新聞報道も大きく扱ったようです。
紙面では、” 胃や大腸など、がん全体で、10年後の生存率は59・4%” と発表されています。専門的ながん医療を提供している全国240施設の約24万症例を対象にした調査で、これまでに発表された10年生存率の統計で、最も大規模なものです。がんは不治の病とされていましたが、実際には半分以上の方が生還されているということは驚きをもって迎えられたと思います。
ちょっとひっかかったことです。私が読んだ新聞数紙では、”胃がんや大腸がんなど” と書かれていることが多かったのですが、皆さんの新聞ではどうですか?すでに女性は大腸がん、肺がんの順で亡くなる方は多いので、すでに4位に落ちた胃がんをトップに述べるのは“古いな”という印象です。いまでも胃がんががんの象徴なのかな、と推測できます。マスコミの方々の頭脳の刷新をしてもらいたいものです。
がんの種類別では、10年生存率が最も高いのは前立腺がんで、98・7%。女性の乳がん(87・5%)、子宮内膜がん(83・0%)、子宮頸(けい)がん(70・7%)、大腸がん(67・2%)と続きました。私の就任のあいさつでも書かせていただいたとおり、乳がんの生存率の高さが際立ちます。(前立腺がんだけは統計の処理の違いで、少しおかしなデータになっています。)
ただここまでは新聞でも描かれている記事ですので、私は別の視線から記事を深堀してみたいと思います。毎日新聞のサイトには部位別がんの5年、10年生存率のグラフと数値が出されていました(https://mainichi.jp/articles/20210427/k00/00m/040/039000c)。だれでも見られるので参考にしてみてください。
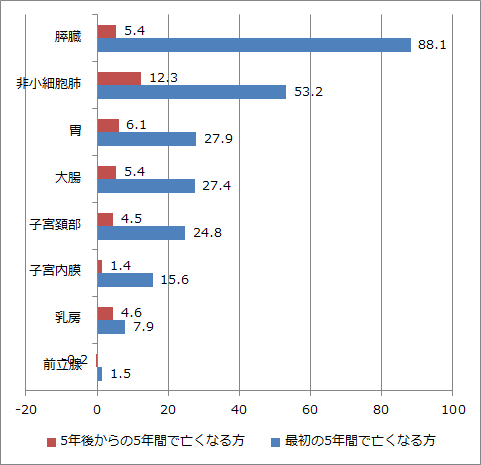
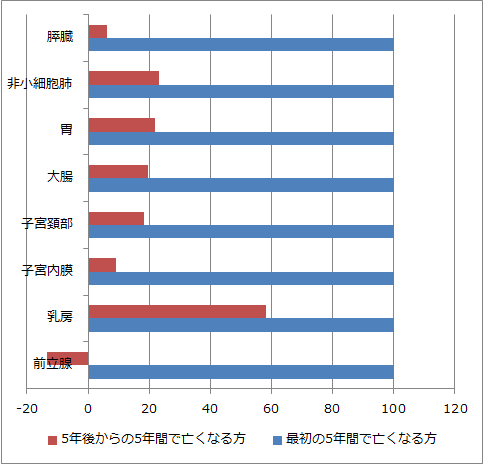
例えば大腸がんではそれぞれ72.6%そして67.2%です。100からマイナスしてみます。すると大腸がんでは最初の5年で27.4%なくなり、その後の5年間でさらに5.4%なくなる計算になります。
胃がんは72.1%、66.0%ですので、27.9%、6.1%となります。子宮内膜がんは84.4%、83.0%ですから15.6%、1.4%、子宮頸がんは75.2%、70.7%なので24.8%、4.5%になります。こうして5年間で亡くなる方、その後の5年間で亡くなる方を計算して、グラフ化してみました。
下、左のグラフがそうです。そのままではわかりにくいので右に計算しなおしました。右のグラフでは最初の5年間で亡くなる方を100とし、そこからの5年間で何人が亡くなるか、揃えてみました。乳腺で赤が飛びぬけて高いと感じませんか?
これが乳がんの特徴です。子宮内膜がんやすい臓がんはその逆で低い。つまり最初の5年間を生き抜けば、その後はずいぶん安心と言えます。ところが乳腺では60%相当の方が次の5年で再発されるため、油断できません。
乳がんの患者さんでホルモンレセプター陽性乳癌として、毎日ホルモン剤を飲まれている方がおられます。2008年の段階ではこれらの方のほとんどがホルモン剤を5年で終了していました。現在では患者さんによりますが延長され、10年、15年継続して飲まれている方もおられます。さて乳癌の患者さんの中でホルモン剤を飲まれている方の割合はどれくらいかご存知ですか?60から70%なのです。それらの人が5年間無事に過ごされて、その時点でホルモン剤を完了している。もしその時点ではがん細胞は消えておらず、ホルモン剤によって抑え込まれていただけだったとしたら…
もちろんホルモン剤を5年で終了したすべての方がその後の5年間で再発するのではないので、60%で一致しているのはただの偶然です。ただ相当に不気味であることは事実でしょう。実際、乳がんならでは特徴である、5年の経過だけでは安心できない、その原因にホルモン剤の影響があることは間違いない事実です。
このことを解説した記事を4月23日に書きました(https://www.nishihara-breast.com/blog/2021/04/4/)。ここでもう一度参考にしていただければ、さらに理解が深まると思います。ホルモン剤を飲まれている乳がん術後の方はここでもう一度、深堀して考えていただければと思います。
■「乳頭からの異常分泌」についてお話します。
通常、乳腺は人生の中で授乳期以外にはあまり役割がありません。そのため乳腺は妊娠し、授乳を行って初めて完成する、体の中ではもっとも遅く成熟する臓器といわれています。
乳頭には目には見えませんが、非常に小さな穴が開いていて、“乳管”と呼ばれる管で乳腺に連絡しています。妊娠がきっかけで初めてこの乳管は完全に開通し、乳腺で作られた乳汁を乳頭に運びます。
下の写真では、授乳期ではないのに、乳頭からさまざまな分泌液が出てきたことで来院された患者さんの写真を示しています。このように普段は意識をしていなくても、乳頭にはきちんと穴が開いています。授乳が始まればそこからミルクがでてくるのは当たり前ですが、そうではない時にミルクではないものが出てくるのは異常です。
しぼると赤ちゃんもいないのに乳頭からおっぱいが出てくる、知らない間にブラジャーなどの下着にしみができている、じくじくして気持ちが悪い、下着にできたしみをよく見ると出血しているなど、乳頭異常分泌にはさまざまな訴えがあります。こうした訴えは妊娠し、授乳経験がある方に多い傾向がありますが、妊娠経験がない方でも認められることがあります。
■乳頭異常分泌の原因
原因には、ホルモンの異常、乳管(乳腺から乳頭まで乳汁を運ぶ管)の感染や炎症、そして乳管の良悪性腫瘍などが考えられます。
こうした異常分泌が見られる際に、写真の左側のような、両方、あるいは片方であっても乳頭のさまざまな部位から出てくるミルク状の分泌、黄色を帯びた透明な液体は、その多くが問題ない所見と思ってかまいません。もしこれらがすべてがんからの出血であれば、乳腺全体ががんに侵されており、まして両側であれば両方の乳腺がいっぺんに乳がんに侵されていることになります。そんなことはめったに起こりません。したがって写真のようにいろいろなところから出てくる分泌物は、がんが原因でないと考えるほうが自然です。
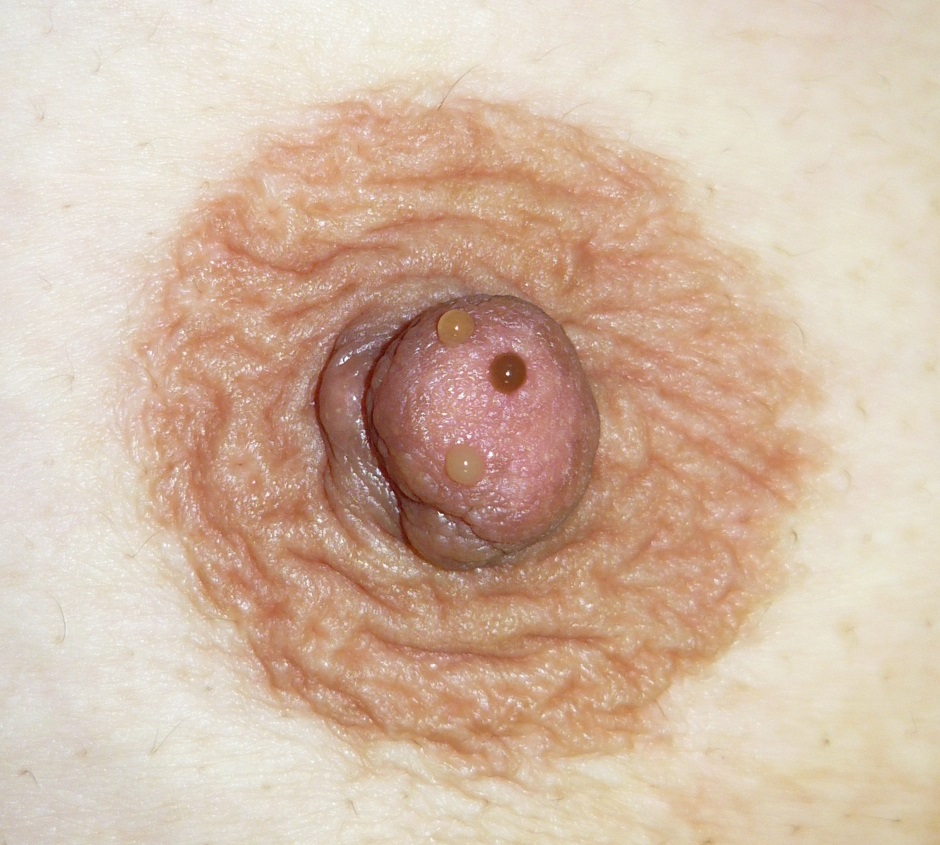
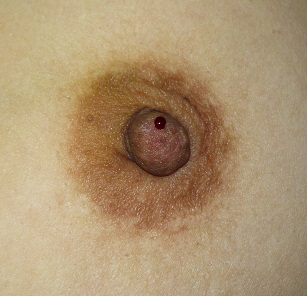
そのことから逆に問題になるのは、「血液を混じた分泌物」が、「片方の乳頭(もっといえば乳頭のいつも同じ穴、乳管開口部」から、「持続性」に認められる場合です。写真で言えば右側がそれにあたります。こうした分泌物は、乳管にできた腫瘍が原因となっていることがあり、早めの精査が勧められます。
写真でははっきりとした出血ですが、こうした例はむしろ外傷や、術後に認められるもので、ほとんどの症例は出血といっても、真っ赤な血液が出てくることは少なく、赤み、あるいは茶色みを帯びたどちらかといえば透明な液体が出てくることが多いようです。その分泌液に血液が混じっているかどうかは、反応液をしみこませた試験紙を使うことで簡単に調べられます。
そして実際に血液が混じっているとなれば、さらに詳しい検査になります。
大腸がんの検査で、便潜血を調べ、血が混じっていることがわかれば大腸ファイバーをして、がんがないかどうか調べますね。それに考え方は似ています。
左側の写真の患者さんでは、乳頭のいろいろな部位から黄色の浸出液が出ている。明らかな出血は認めない。
右側の写真の患者さんでは一つの孔から、明らかな出血が認められる。この方では絞らなくても持続的に出血しており、入浴すると、お湯に糸のように血が流れているのが見えたと言われていた。
■乳頭異常分泌の検査
乳頭異常分泌を主訴に来院された患者さんであっても、通常通り、マンモグラフィと乳腺超音波検査が行われます。この二つの検査は乳腺の検査のゴールデンスタンダードです。それで何か異常があれば、それから異常分泌の原因が推察されますので、それを優先的に検査します。
問題は、マンモグラフィと超音波検査のどちらにも異常が認められない場合です。
今までのお話の中にも出ましたが、乳頭には乳汁を出すための穴があります。非常に細く、また普段は閉じているため肉眼ではなかなか確認できません。ただ技術的にはその細い管を探し当て、挿入し、中を観察することのできる「乳管鏡」という内視鏡が開発されています。右の写真はその実際の風景です。細い針のようなカメラですが、決して「刺して」いません。挿入されています。もちろん局所麻酔も使って痛みのないように検査されます。そういうところまでは便潜血が認められた時、大腸ファイバーを挿入し、検査する、流れとそっくりです。しかし乳管内視鏡は、あまり普及しておらず、特定の施設でなければ持っていません。われわれも持っていません。
乳管内視鏡はその構造上あまりにも細く、かろうじて観察のみ可能で、たとえ何か病変を認めたとしても、その一部を採取したり、調べたりすることがほぼできません。がんと診断をつけるためには、結局ほかの検査方法に頼らざるを得なくなることが原因です。
つまり乳頭から異常分泌があり、乳管鏡で何かが見えたとしても、それがマンモグラフィや、超音波検査で捕まらないのであれば、それは数㎜大の極小な病変であり、それがすぐに命にかかわるような事態にかかわることはほとんどないのです。経過観察し、その他の検査で認められるようになってから、確定診断がついたとしても、それで十分治癒させ得る、と考えられているのです。
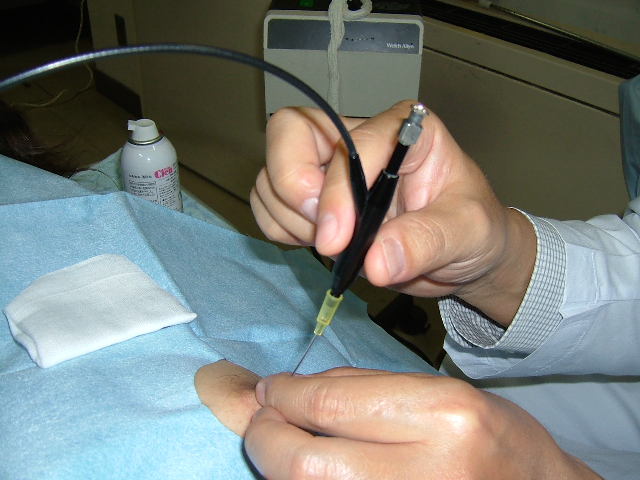
乳管鏡を実際に施行しているところ。
カメラなので先は針ではありません。細いグラスファイバーを乳管の中に挿入して、内部を観察します。ただほぼ観察しかできません。
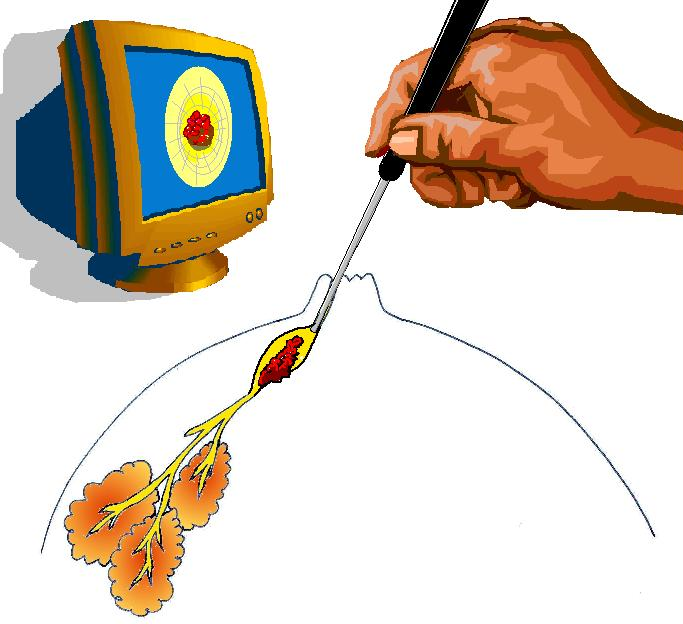
図にすると こういう感じで検査は行われています。
実際の乳管鏡の画像から、この乳管は正常な粘膜におおわれています。なめらかでつるつるしており、きれいなピンク色です。
少し離してみてください。赤くて丸いポリープがあることがわかります。この病変は乳管内乳頭種と呼ばれる良性のものでした。
■乳頭異常分泌への対応
先に述べましたが、マンモグラフィ、超音波検査、場合によってはMRI検査まで行われますが、それでも異常が認められない場合には原則、経過観察で問題ない場合がほとんどです。
乳管内視鏡をして何かを見つけても、その検査だけで診断を確定することはできず、そして結局主訴である異常分泌をとめることもできないため、この検査は普及していません。我々の施設でもこの内視鏡はできません。
ただ患者さんにとって、ずっと継続している出血や分泌は、下着も汚れ、場合によっては衣服も汚れるので不快なものでしかありません。ましてやポリープや、場合によっては極小だといっても、乳がんが潜んでいる場合もあるとなければ気にもなります。
最終的には全身麻酔下に行われる「選択的腺葉区域切除術」によって、この原因を排除し、根治させるとともに、診断を確定させることができます。(手術の内容はここでは触れません)
もちろん全ての患者さんにこの手術を受けることは勧められません。先述の通り、
1. 血液を混じた分泌物が、
2. 片方の乳頭、もっといえば乳頭のいつも同じ穴、乳管開口部から、
3. 持続性に認められ(我々のデータでは平均3か月観察しています。出血が多い、ご高齢、MRIで所見がある、などがあれば、観察期間を短くして手術に踏み切る傾向があります)
4. マンモグラフィや超音波検査で所見がない、あるいは診断が確定できない場合に勧めています。
私が部長をしていた姫路赤十字病院では、実際にこの方針にのっとって手術を行っていました。昨年末にこうして最終的に手術を行った133例の患者さんの解析を行いました。結果 85.1%の患者さんに良性悪性を含めて何らかの腫瘤が発見され、37.6%で乳がんが発見されました。もちろんそのすべてで乳頭出血の主訴は消失しました。そして乳がんと診断されたほぼすべてがステージ0から1の早期がんで、実際乳がん症例の73.7%はステージ0の非浸潤性乳管がん(DCIS)と呼ばれるほぼ治癒が期待できるものでした。
したがって乳頭異常分泌を認める方はこの基準にのっとって経過観察し、定期的に検査をし、その過程で手術をする、しないを決定していくことで問題はない、と言い切れると思います。不安や疑問があれば時々に応じて相談しながら、検査と経過観察に付き合ってください。
■セカンドオピニオン
それでも、もし他の病院で検査を受けてみたい、意見を聞きたいと思われたら、遠慮せずにおっしゃってください。だまって行かれたら、全ての検査がそちらの病院でもやり直しになります。気になされることはありません。紹介状を書き、今までの検査結果をお貸しいたしますので、おっしゃってください。そのことで患者様の今後に不利益があることは決してありません。
にしはら乳腺クリニック院長 渡辺直樹
Q: 乳がん患者はCOVID-19のワクチン接種は可能ですか?
最近、外来で経過観察させていただいている患者さんによく聞かれる質問に答えさせていただきます。ただご存じの通り、日本ではまだ数%の方しかワクチン接種を受けておらず、日本人のデータそのものが乏しい状況です。まして乳がん患者さんに摂取して何が起こるのかは世界的に見ても研究がまだ進んでいません。そこでここでは接種の進んだ米国のデータから参照しました。ここで述べるデータは米国の国家機関から国民に向けて行われた発表内容ですので、信頼できるデータです。www.breastcancer.org/about_us/press_room/news/coronavirus
A: 答えはYESです。COVID-19ワクチンは緊急使用下において認可が下りていますが、現在乳がんにて治療中、そして過去に乳がんに罹患した経験のある方でも安全かつ有効であると考えられています。米国疾病予防管理センター、米国総合がんセンターネットワーク、そしてその他専門医による団体は、担癌患者さんにむしろ優先的にワクチン接種を受けるよう勧めています。もちろん各個人の状況は異なりますので、実際の摂取に当たってはまず主治医と相談することを勧めています。
2020年12月、アメリカ食品医薬品局はファイザー社、モデナ社製のCOVID-19ワクチンの緊急使用を認可しました。ジョンソンエンドジョンソン社製のワクチンは2021年2月に許可しました。他国で使用されているワクチン、そして新しく開発も進んでおり、順次認可していきます。
2021年4月にアメリカ食品医薬品局、米国疾病予防管理センターはジョンソンエンドジョンソン社製ワクチン使用について、“多くの検討事項の発生”を受けて、一時停止処分を決定しました。これによって医療関係者に、ジョンソンエンドジョンソン社製ワクチンを使用して血栓症を発症した6名の患者さんを含めて、これらを調査し、対応する時間的猶予を設けています。(最近解除されたようです。ただ血栓症についてはまだ完全には解明されておらず、注意喚起が添付されているようです。2021年4月25日注 ファイザー社、アストラゼネカ製のワクチンでも血栓症の報告は0ではないようです。すでにジョンソンエンドジョンソン社のワクチン特有の副作用ではないのでは、との報告も出ているようです。2021年6月注)
ワクチンは活性のあるウィルスを含んでいるわけではありません、ですので、がんの治療中などの理由で治療免疫が弱った方に使用することに問題があるわけではありません。アメリカ食品医薬品局はこれらのワクチンが安全で、かつCOVID-19の感染、重症化、そして死亡から身を守るのに有効であることを確信しています。ただワクチン接種しても、その効果がいつまで続くのか、そして接種後にウィルスにさらされた時、自分は症状のないまま、それをそのままほかの人に感染させないのか、まだわかっていません。ですので、マスクを着用し、距離をたもつことをワクチン接種のあとも継続するよう勧めています。
専門家はいまがんの治療中の方、がんの既往歴のある方、いずれもCOVID-19のワクチンを受けられることを勧めています。ただそれぞれの方で事情は異なりますので、実際に接種の際には、その判断が正しいかどうか、主治医に相談してから受けるようにしましょう。
にしはら乳腺クリニック院長 渡辺直樹
2021.04.23
今のようにコロナが騒動になる前、2019年末 米国で行われた世界最大規模の乳がんの学会(SABCS)において、ホルモンレセプター陽性乳がん患者さんが5年間ホルモン剤をのみながら再発なく経過して、“ホルモン剤を終了した”、そういった方をそれ以降15年、合計で20年間も経過観察した治療成績のまとめが発表されました。なんと110の臨床試験、約8万人の乳がん症例をまとめて検討した非常に大規模なもので、こうしたものはメタアナリシスと呼び、もっとも信頼性の高い学術的な証拠として扱われます。
この話題は、ホルモン剤を何年飲んだら安心できるのか?ということに関して一つの考え方を教えてくれるものです。これを掘り下げていこうと思います。

N Engl J Med 2017; 377:1836-1846 / DOI: 10.1056/NEJMoa1701830
まず基礎的な話から始めます。
上記のグラフは2017年の発表のものです。このグラフは「5年間再発なしで無事に経過された人が、ホルモン剤を終了とした後、どれくらい再発するのか」を示したものです。ですので5年後からグラフが立ち上がっています。黄色の線はT1N0と書いてあります。つまりリンパ節転移もなく、腫瘍径が2㎝以下、ステージ Iとされる早期乳がんの患者さんを扱ったグラフです。黄色の線では10年後に4%、15年で8%、20年で13%が示されています。つまり先に示した早期乳がんの方が5年間 ホルモン剤を飲まれ、再発なしに元気に経過され、そこでホルモン剤を中止されると、そこから15年後には13%の方が再発されている、ということが示されています。
重要なのはたとえ20年経過していても再発するリスクが消えていないことです。
乳がん術後の方が、ホルモン剤を飲まれながら5年間無事何事もなく経過されたとして、その中にはもちろん乳癌が完全に治癒されている方もおられます。こうした方はその時点から、もしかすると術後すぐからホルモン剤を飲まなくても問題はなかったはずです。黄色の線に属する方では少なくとも9割の方はそうです。そして一部の方では残念ながら体のどこかにまだがん細胞が生き残っています。しかし飲んでいるホルモン剤によって、女性ホルモンによる信号がブロックされており、増殖はせず、その場でおとなしく眠っています。もちろん検査では捕まらないような小さな小さな転移(微小転移といいます)です。グラフの黄色に属する人では、5年たった時点でもこうした方が1割以上はおられるのです。そしてホルモン剤を中止した後、次第に戻ってきた女性ホルモンレベルに刺激を受け、活動を再開し、増殖し、姿を現し、転移として発見されます。そういった方であるリスクが1割はある、ということになります。
ここから本題です。
先に示した2017年のデータは、HER2陽性の患者さんが入っています。ご存知の方もおられると思いますが、HER2陽性の患者さんではもちろんホルモン治療も重要ですが、ハーセプチンを中心とした抗がん剤、つまり化学治療をしっかり行っていないと、いくらホルモン剤をきちんと飲んでいても再発しやすいことがわかっています。ハーセプチンによる治療の重要性が“常識”となって、全国でしっかり徹底されるようになったのは2000年以降です。2017年の20年前は2000年より前になってしまい、ハーセプチンでちゃんと治療されていない患者さんのデータが強く反映されます。そこで2020年のデータとしてハーセプチンの治療が徹底された以降のデータを検討してみようというのが2019年今回の発表の趣旨でした。
もちろんそれ以外も乳がん治療はずいぶん進歩しました。たとえば2000年以前と以降では、化学治療が施行されている割合は43%から64%まで増加し、タモキシフェンではなく、アロマターゼ阻害剤が使われている割合は12%から58%まで増加、さらにHER2陽性症例へのハーセプチン使用割合は0%が40%まで増加しています。当然結果はより改善していることが予想されます。
今回の発表で2000年以前と以降を比較した結果、こうした早期乳ガン患者さんが再発するリスクは、RR0.73(0.64から0.85)と、幸いにも27%!も低下していることが分かりました。下に示したグラフが実際に発表されたグラフです。


グラフは10年までが実線、それ以降は点線です。つまり10年以降は計算上の予想です。
今後、T1 N0 ステージ I の患者さんに関して、「5年間再発なしに無事にホルモン剤を飲んで経過され、そこでホルモン剤をやめてしまうと、その後15年間で10%近くの方が再発する」 という試算が今回示されました。もちろんより進んだステージだった方ではそれよりも高い確率が予想されます。ですから5年経過された方が、その後も継続してホルモン剤を飲んでいくことを勧める、という結論に変わりはないでしょう。
しかしそれではホルモンレセプター陽性乳癌患者さんは、10年たっても15年たっても、永久にホルモン剤を飲まなければならない、ということになります。しかしホルモン剤も無料ではない。そして骨粗鬆、子宮内膜症、そしてわずかではあるが子宮体癌のリスクが上がるなど、様々な副作用、リスクがあります。こうした患者さんは永久にホルモン剤を飲むべきなのでしょうか?
ここからは私見として読んでください。私の患者さんに対して自分はこう考えて治療に臨んでいる、ということです。
例えば70歳前後のホルモンレセプター陽性乳癌患者さんがおられたとしましょう。黄色の線で示されたT1 N0 ステージ I の早期の方です。ホルモン剤を飲まれ、5年無事経過しました。
さて、この方が80歳になれず、乳がん以外の理由で亡くなる可能性は計算上12%あります。寿命でなくなる可能性が12%はあるということです。
一方乳がんの再発で亡くなる可能性は6%以下です。
ホルモン剤を中止せず、継続して飲めば6%まで改善することは確実です。しかしそれでも0まで下がることはありません。それでも ほかの病気やがんなど、寿命で亡くなる可能性のほうがよほど高いのです。
ホルモン剤を辞めても、ほかの病気で死んでしまうほうがよほど可能性は高い、それならばもうホルモン剤は辞めていいのではないか、自分はそう考えます。
ホルモン剤を飲むことで使うお金があれば、そしてまだまだ長生きしたいのであれば、他の疾患、他の臓器のがんの検診に費やしたほうがよほど効率的と言えます。ここで70歳を60歳と入れ替えるとどうなるか。この方が70歳になれず、他の疾患で亡くなる可能性は5%です。50才ならどうか?他の疾患で亡くなる可能性は2%、これなら乳がんで亡くなる可能性は無視できませんよね。
これらのことから、ホルモン剤を5年完了した時点で70歳を超えておられる方であれば、ステージ Iの早期乳がん患者さんではホルモン剤を辞めていいと考えています。60歳の方は検討してもいいでしょう。もちろん辞めろ、ではありません。得られるものと失うもののバランスが悪い、と考えます。最終的には主治医とも相談しながら決めていけばいいでしょう。
効果があるからと言って、全員が永久にホルモン剤を飲み続けることが正しいとは言えません。かといって効果があることがわかっていながら年齢を理由に全ての人に飲用を辞めていただくことも間違いです。それぞれの状態に応じて、ホルモン剤を続けるメリットとデメリットを正確に理解し、主治医と相談しながら今後の服用を柔軟に決めていく、それが正しい解決方法と言えるでしょう。
ご予約専用ダイヤル
079-283-6103