2021.05.27
後編では様々な具体例を挙げながら、嚢胞について解説をしていきたいと思います。
以前 “高濃度乳腺とは -Are You Dense?-”(https://www.nishihara-breast.com/blog/2021/04/3/)の記事で、マンモグラフィの検査を受けても乳腺濃度が高いために非常に診にくい方がおられる話をしました。戦前のように、子供さんを4人5人とたくさん作られて、ずっと授乳もしてきた、という女性が少なくなった昨今、乳がんの好発年齢でもある40歳から60歳までの女性のマンモグラフィは”不均一高濃度”であることがほとんどです。授乳を終え、しかし閉経しておらず、生理は継続している、こうした年齢の女性の乳房を超音波検査で観察すれば、ほぼ全例に嚢胞は見つかります。嚢胞そのものはまず良性で、ほとんどの場合で内部にポリープなどは存在せず、発生もせず、ありふれた乳腺の”変化”にすぎません。ただその一部に注意が必要な嚢胞が存在するのも事実です。先に述べた理由で、乳腺に嚢胞が存在するような年齢の女性ほど、マンモグラフィだけでは嚢胞の観察は難しいのです。不均一高濃度乳腺においては、高濃度ほどではなくても、部位によっては高い濃度で乳腺が残っており、微小な病変を観察、発見することは困難です。そして嚢胞を発見できたとしても、その内部にポリープができているかどうか判断できることはできません。
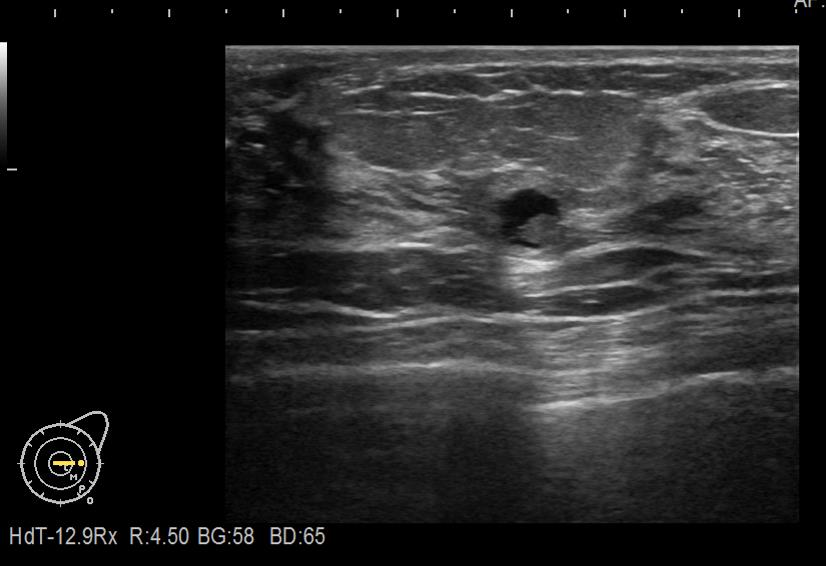
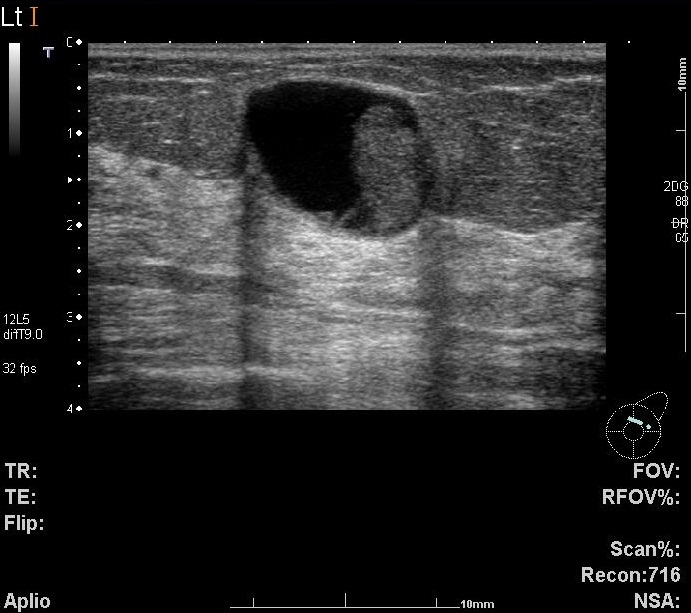
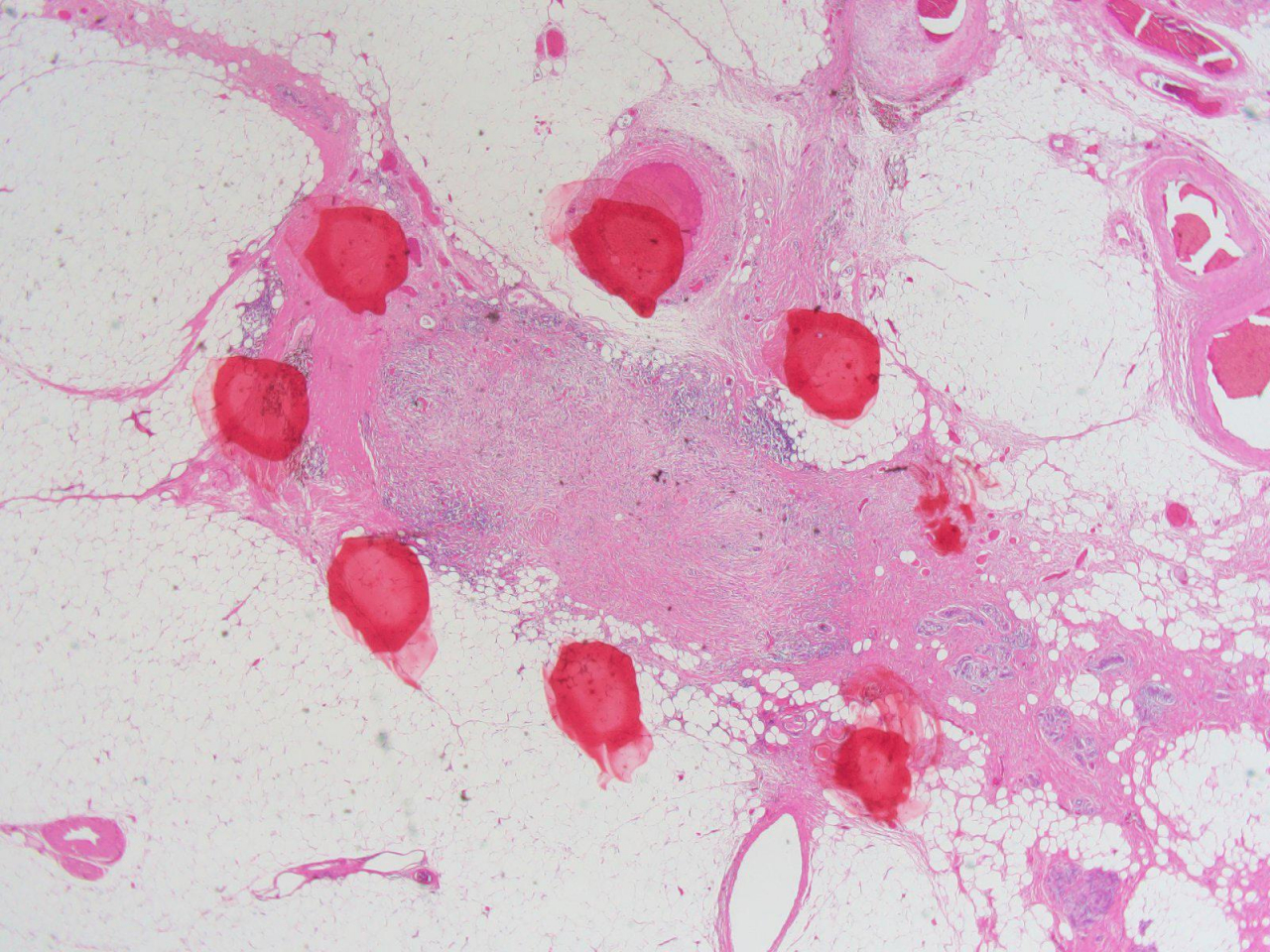
上の写真の方では、乳腺超音波検査で嚢胞の中にポリープが見つかりました。左側の乳頭の下に6㎜大の嚢胞があり、その内部に4㎜大の隆起が存在していることがはっきりわかると思います。
ではこの方のマンモグラフィを下に提示します。ごらんのとおり、乳腺が高濃度に残存しており、不均一高濃度乳腺とされるマンモグラフィ像です。
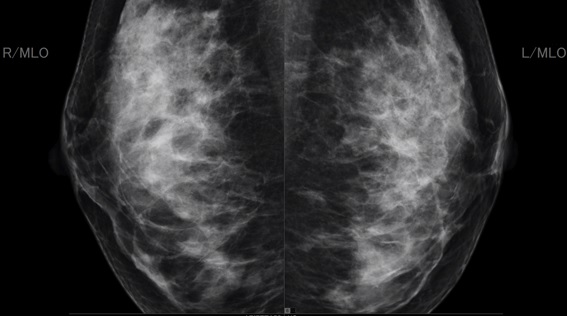
先に超音波検査の画像で示した通り、左側の乳腺の乳頭の下にはこの嚢胞が存在します。しかしマンモグラフィでいくら探してもみてもその嚢胞自体を見つけることは難しく、さらに内部のポリープはなおさらのこととして観察できません。
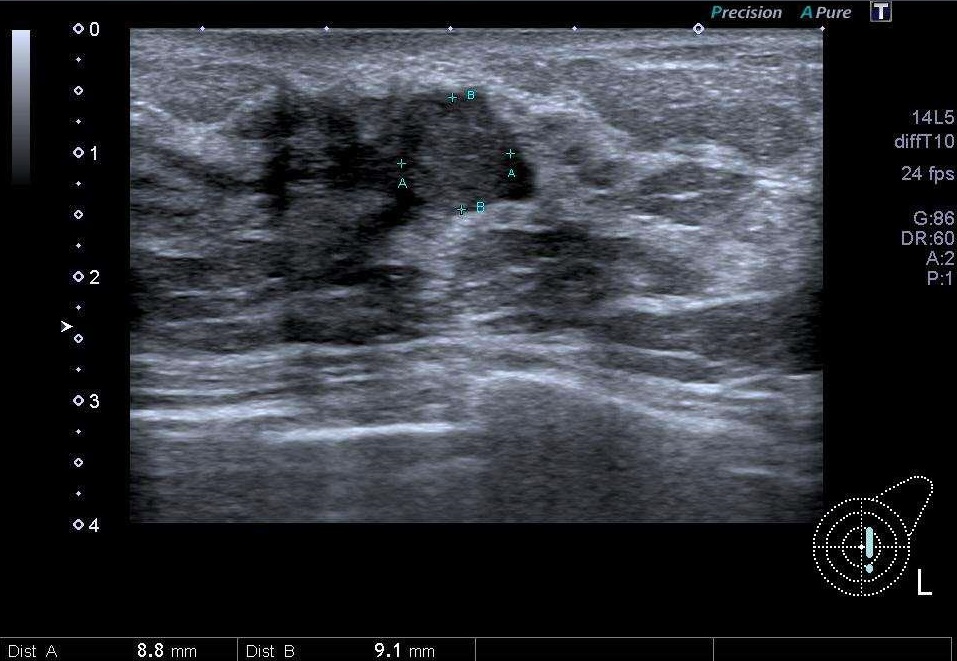
この超音波検査の写真ではさらに大きなポリープが、不整な形をした嚢胞の中にあるように見えます。倍率が違うので大きく見えますが、9㎜程度です。マンモグラフィでは同様に確認できませんでした。
この症例では、乳腺超音波検査をしてポリープが見つかりました。はたしてがんなのでしょうか?
診断を付けなければ、となるのですが、ここでも難しい問題が出ます。
胃や大腸と異なり、乳腺のポリープはカメラで切除して採取することはできません。
手術をすれば採取できますが、良性であれば本来手術は不要です。こうしたポリープを手術で全て切除することなしに、良悪性を鑑別することは大変難しい問題です。この写真の患者さんは細胞診で良性と診断されましたが、切除を希望され、この嚢胞を切除して検査することになりました。
ここでもよかったら“病理検査の順序 ~がんの診断を付けるために~”(https://www.nishihara-breast.com/blog/2021/05/11/)を参照してください。
手術せずに診断を付ける方法は様々なものがありますが、その一部を採取して調べている以上、その腫瘍の”どこにもがんはないか?”にこたえることはできません。まして今はよくとも将来がんになることはないのか、には答えられません。大腸のポリープも良性とされても原則切除されているのはそのためです。乳腺ではしかしそのためには手術が必要になります。
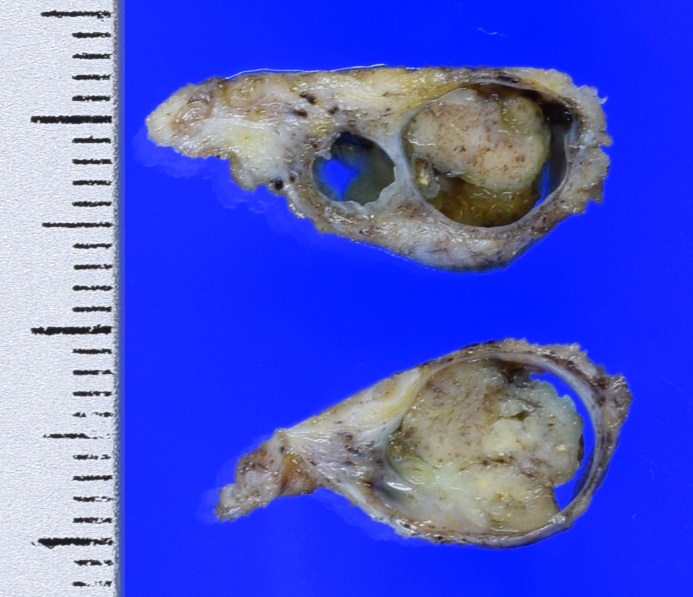
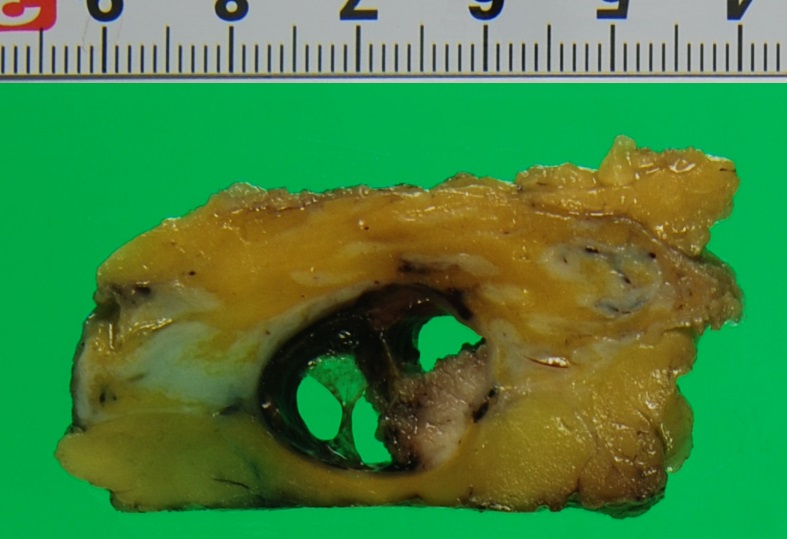
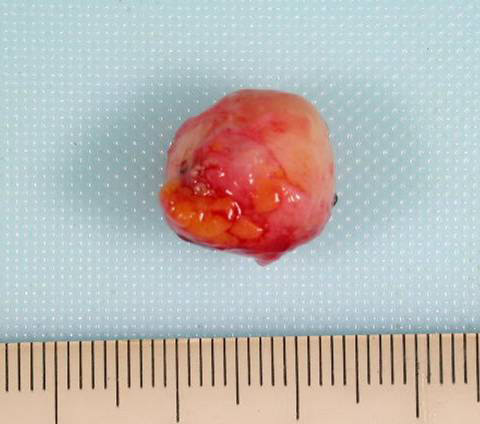
上の写真は切除された先の嚢胞です。このように嚢胞の中に包み込むようにポリープを全て切除して検査をしました。結果は良性(乳管内乳頭腫=乳管の中にできたポリープという意味です)でした。もちろん結果として手術はせずに経過を見ていても大丈夫な方であった、という結論になります。ただ術前にそれを確信もって決定することができなかったのです。
大きさから判断するのはどうでしょうか。この方のように比較的小さなものは良性であることが多いのですが、大きくても良性であったり、小さくても悪性であることがあります。
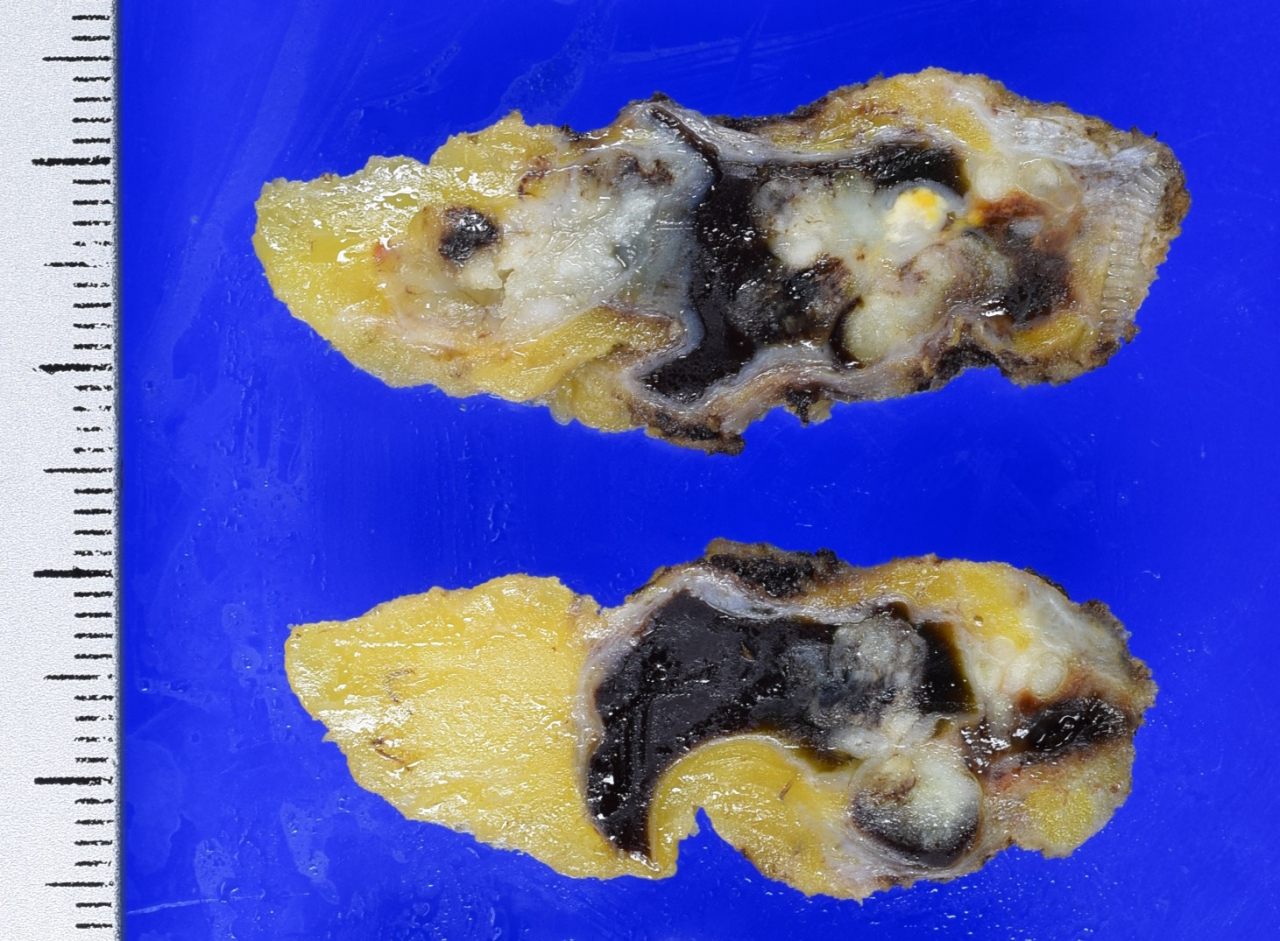
上に示した写真の方では不規則な形をした巨大な嚢胞の中に出血(黒い部分は血の塊です)を伴うポリープを認めます。見るからに悪性のもの、がんに思えますが、良性の乳管内乳頭腫でした。ただこうしたものが超音波検査で指摘された場合、細胞診などで良性と診断されていても、経過観察とするのは患者さんも、そして医師からしても勇気が必要です。
次の写真の方は大きさこそ大きく、嚢胞1.5㎝、内部のポリープは1㎝程度あるのですが、先の写真の方と比較して、形も丸く、スムーズで、あまり悪そうに見えません。良性のように見えます。ただ切除してみると、これは病理検査によって最終的にがんである、と診断されました。
嚢胞内に腫瘤を疑う隆起を認めた際に、それが広基性である(嚢胞の壁にべったりとつくように存在しているように見える、茎がないように見えることから無茎性とも言います)場合は悪性を疑い、いわゆるポリープのように茎が存在している有茎性の場合は良性を疑うという原則があります。これは胆のうポリープなどでも通用する概念です。この方では有茎性ですから良性が疑われます。
このように、乳腺超音波検査による検診を受けて、嚢胞を観察し、その内に腫瘍を発見できたとしても、画像から判断できる形状や大きさからだけで、それが良性か、悪性のがんであるかを診断することは困難です。
ただ幸いなことに、こうして嚢胞の中に存在しており、周囲に浸潤していく性質を示さない腫瘍は、たとえがんであってもおとなしく、成長がゆっくりしたものが多い傾向があります。診断が難しくても、必要に応じて検査を受けながら経過観察をしていく中で、増大する、形が変わる、出血する、など悪性を示唆する所見がなければまず良性だろうと最終的に判断できることがほとんどです。
さまざまな実例を挙げることでかえって混乱された方も多いと思います。ここまで述べたことを参考としていただきながら、嚢胞があると言われたら、についてまとめたいと思います。
#1 マンモグラフィだけで嚢胞を見つけること、嚢胞であると診断すること、嚢胞の内部にポリープは存在しない、と診断することは難しく、とくにマンモグラフィで乳腺濃度の高い方では、検診の際に乳腺超音波検査を併用することが勧められる。
#2 嚢胞が見つかっても、その多くは良性で、内部にポリープを疑う隆起を認めなければまず問題はない。
#3 嚢胞が見つかった際に、その内部にポリープを疑う所見があれば、良性であると確定するまでさまざまな方法で病理検査が行われる。
#4 ポリープを認めた場合、病理検査で良性と診断されても、完全に切除されたのでなければ、定期的に乳腺超音波検査を用いて経過観察しておくことが勧められる。
2021.05.21
乳腺超音波検査を受けると、「嚢胞があります」と言われることがよくあります。乳腺嚢胞はほぼすべての年齢層の女性に見られ、原則として良性であり、ほとんどの女性の乳房に必ずと言って認められるような、そんなとてもありふれた病態です。浸出液をたたえたただの袋のような病変で、基本的には良性ですが、注意しなければならないことがあります。ここではそれについて2回に分けて解説していきます。なおここで書かれた記事は、乳頭異常分泌についてのコラムを読んでから読まれると理解がより深まります。よかったら先に目を通しておいてください。
乳頭異常分泌について https://www.nishihara-breast.com/blog/2021/04/6/

大腸の粘膜にはポリープができます。ポリープは“茸(タケ)”という意味になります。実際の大腸内視鏡の映像を下に示しますが、左の写真のポリープはまさに茸ですね。
カサの部分があり、茎もあるように見えます。しかしこの茎はカサによって粘膜が引っ張られているだけで、茎の部分はほぼ正常な粘膜です。本体は先の傘の部分です。
そのため、先に示したまさに椎茸のようなポリープも存在しますが、時にそれが大きくなり、粘膜に広がって存在するために茎を失ってしまったように見える(広基性といいます)ポリープも存在します。下の写真の右側がその典型です。
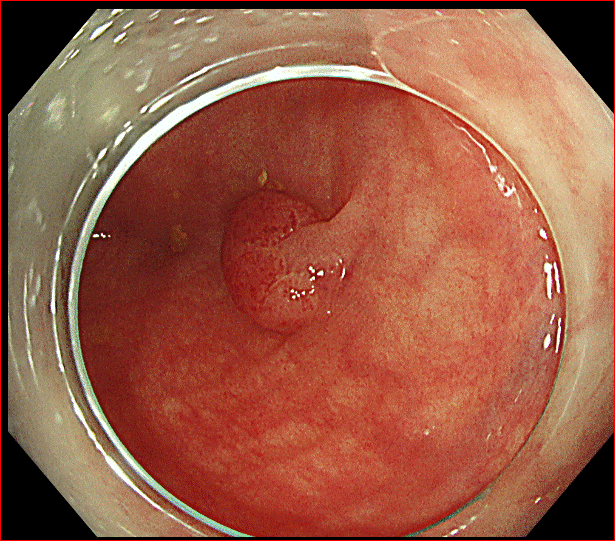
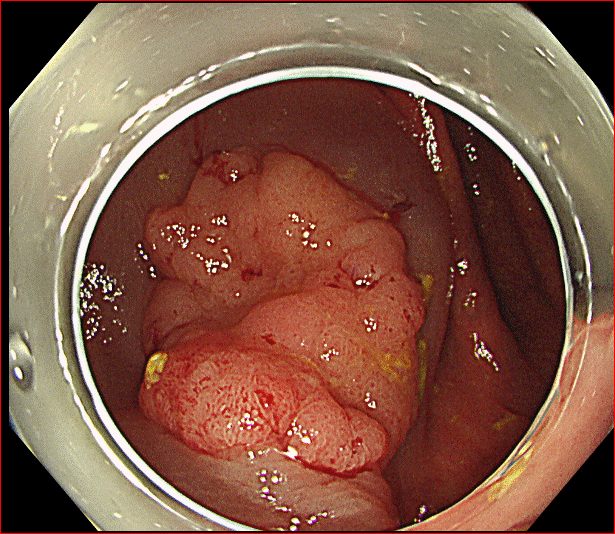
内視鏡でポリープが見つかれば切除されます。ポリープは良性です。それでも見つければ原則として切除されるのは、将来そこからがんが発生する可能性があることがわかっているからです。大きくなったポリープは、小さいものと比較して、発生してから時間がたっていることが推察されます。もし時間が経っていなかったとしても、短い間に大きくなることもまた悪性度を表します。したがって写真の右で示したような茎が亡くなっているような比較的大きなポリープが見つかれば、経過観察とすることはせず、できる限り早期に切除することが計画されます。
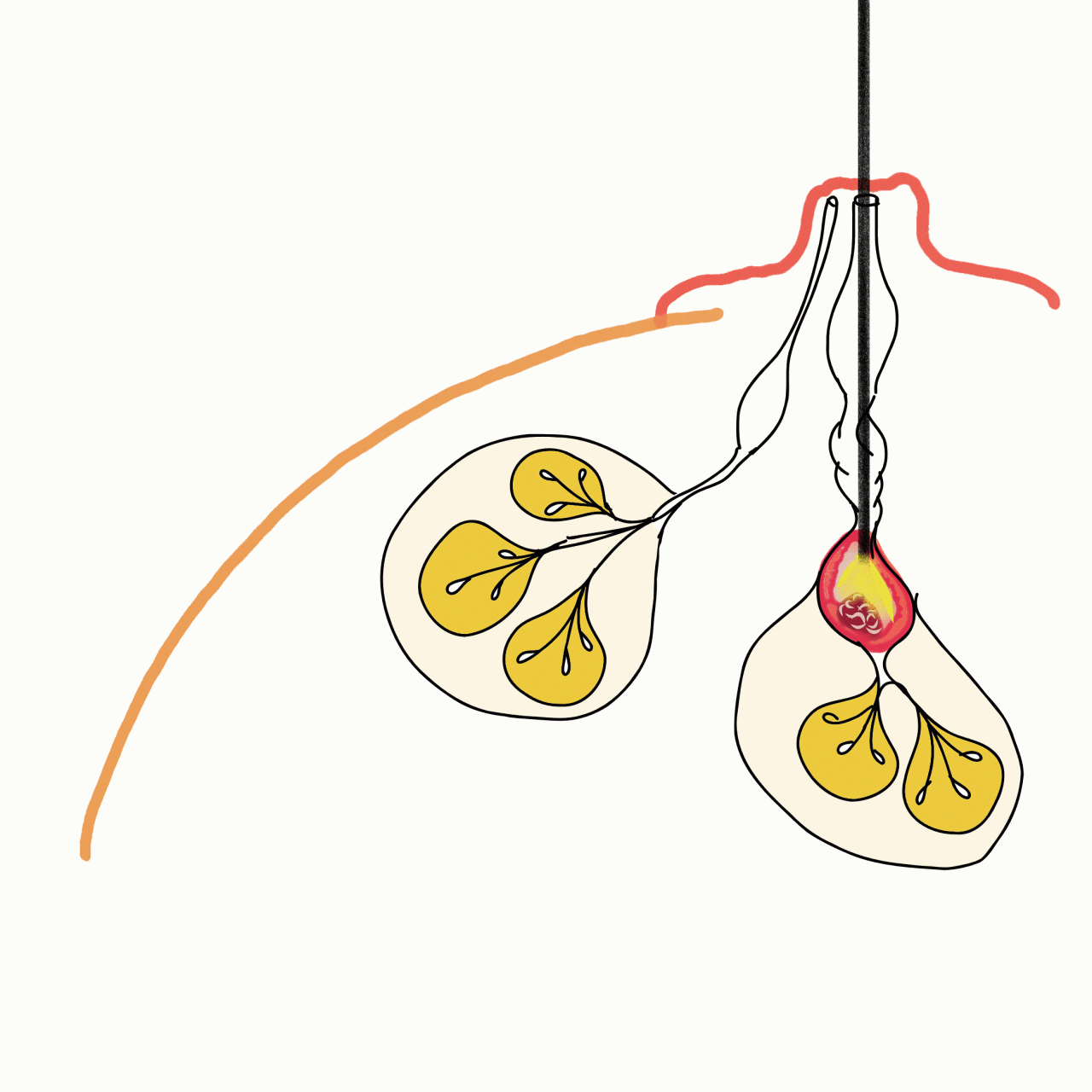
さて大腸ファイバーは、腸管内を下剤によってきれいにし、肛門から内視鏡を挿入することで内部を観察するものです(下の図の左)。
乳腺には乳管鏡という同じく内視鏡が存在します(下の図右)。乳頭には乳管開口部、つまりミルクの出てくる孔があります。通常は閉じていて、肉眼ではほとんど確認できません。これを、時間をかけて少しずつ拡張し、そこに非常に細いグラスファイバー製の内視鏡を挿入して、内腔を観察するものです。ただ大腸は入り口一つの出口が一つの一本道ですが、乳管は枝分かれが何本もあり、さらに奥に進むと細くなります。しかも乳頭には20か所近くの乳管開口部があります。大腸ファイバーと比較しても大変難しく、時間もかかる検査です。加えて、何十分もかけてやっと病変を見つけたとしても、あまりにも細いカメラの構造上、観察はできても、そのポリープをきちんと切除して調べることができないのです。こうした理由からめったに行われない検査となっています。

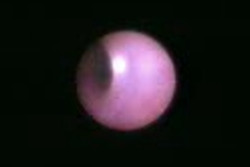
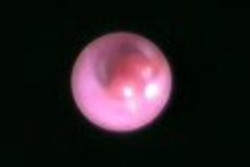
これによって観察された正常な乳管と、内部で見つかったポリープを下に写真で示します。
左に示した乳管の内部はすべすべした艶のある粘膜で均一に覆われています。対して右の写真では下側から赤く発赤したポリープが不規則に内腔に飛び出してきています。
このように、普段意識されることはありませんが、乳腺の中には乳管というミルクを運ぶ管が何本も複雑に走っていて、その内部は粘膜に覆われています。そしてその粘膜には胃や大腸の粘膜と同じようにポリープができ、そしてそれががんに発展することがあります。
以前、乳頭異常分泌のところで触れましたが、こうしたポリープが乳管内にできていることが原因で乳頭から出血することがあります。そしてもしそうした症状があれば、こうしたポリープが存在していることを教えてくれていることになります。大腸がんの検診で、便に鮮血が混じていることを調べることと同じです。ただしそれは乳頭に近いところでポリープができていることが条件です。近ければ出血や浸出液が乳管を通って乳頭まで出てくることがあります。しかしポリープができた位置が乳頭から遠く、乳管内を深い入ったところにできている場合には、こうした浸出液は出てこないことが通常です。消化されたものが常に流れている腸管とは異なり、授乳中でない乳管内には何も流れていないからです。その場合はそのポリープ周辺の乳管内にたまりを作ります。乳腺内のう胞や、乳管拡張症とよばれる病変には、こうして発生した乳管内の「たまり」を捕まえた像であることがあるのです。
ただのう胞や、乳管の拡張を認めた際に、それは必ずしもポリープや、がんによって引き起こされたものではありません。乳腺に発生する嚢胞には様々な原因があることも同時に知っておいてください。
上記に述べたような理由から、のう胞や、乳管拡張を認めた際には、その内部にポリープや、がんができていないか、確認しておくことは常に重要になります。そしてその検査では乳腺超音波検査がもっとも有効です。
後編では具体例を挙げながらその解説をしていきます。
2021.05.10
■がんの診断
マンモグラフィや、超音波検査、MRI、PET検査、CTなど、検診や、がんが疑われた際に施行される様々な検査があります。先に述べた検査は画像を撮影し、それを専門医が見て、病変の有無を判断するものです。画像検査と呼ばれます。
検診ではマンモグラフィや超音波検査が主に行われています。こうした検査で、がんが疑わしい病変や部位を見つけたとき、それががんであるかどうかの‟確定”診断はどうしたらつくのでしょうか。そのためにはそこから何らかの方法で細胞や、細胞の塊である組織を採取し、それががん細胞、がんの組織であることを病理医が顕微鏡検査でそれと確認しなければなりません。もちろんがんの組織ががんですと標識を出しているわけではありません。病理医がさまざまな方向から観察、検討してやっと診断に至ります。
画像検査で発見された腫瘍から、何らかの方法でその一部を採取し、そこにがん細胞、あるいはがんの組織があるかどうかを直接観察し、診断を決定する方法を病理検査と言います。検察が証拠を集め、裁判を行い、判決を行うことによくたとえられます。病理医は裁判官です。
病理検査のためには、腫瘍の一部に到達する必要があり、そこではやはり画像が用いられます。この二つは切っても切り離せません。ただ腫瘍を見つける画像検査は“存在診断”を付けるためのものです。病理検査のためにたとえば針を腫瘍にさす必要があれば、そこでもまた画像を参照します。ここでは病変が存在することはすでにわかっていますから、たとえば両方の乳腺を検査したりしません。画像で針の位置と腫瘍の位置関係を確認しながら、針を慎重に進め、組織を採取します。
最初の検診、つまり存在診断の際の画像検査で、何か見つかった際に、そのままその画像を使って針を刺し、組織を採取して、病理検査まで施行してしまえば、1回の検査ですべて賄えるため、コストも節約できます。ただそれでは針を刺して、出血したり、痛みがあったりしている乳腺をさらにほかに病変が存在しないか、画像検査を継続して行わなければなりません。右の乳腺の針を刺したところから出血しているのに、左の乳腺の検査をするのが異様であることはわかると思います。したがって存在診断のための画像検査と、病理のための画像検査は通常2回に分けて行われます。病変が見つかれば画像検査が最低2回は必要になるのです。

■がん細胞とは
病理検査まで行ったら、それで診断がすぐに確定するでしょうか?そもそもがんは自分の体の細胞から発生したもので、外から入り込んだものではありません。
がんの定義は、「遺伝子変異によって無制限に増殖するようになった細胞のうち、元の臓器を離れても増殖を続けることのできるもの」を指します。
ある限界で止まることなく、つまりがんの患者さんが健康を損ねるレベルになっても止まることなく、増殖を続け、そして元の臓器を離れて転移し、そこでもまた無限に増殖する、それをがんと呼びます。
ただどんながん細胞であっても、体から取り出してしまえば、増殖も、転移もしません。
がんの定義は、取り出してしまえば観察できない性質であり、そこに難しさがあります。病理医は、増殖し続けそうな、そして転移できそうな細胞を同定してがんと診断します。それゆえ、そこには“あいまい”な部分がどうしても残ります。
しかしそんな病理であっても、これは絶対にがんだ、と診断できる特徴的な所見があります。それはその細胞が、元の組織からほかの組織に“浸潤し”、転移を始めたところを認めたときです。つまり組織を大きく採取し、一部であってもそういう性質を示しているところを認めれば診断は確定します。
したがってがんの診断のためには、採取してくる組織が大きければ大きいほど情報が増えて有利になります。良性のものを手術してしまわないよう、逆に悪性のものを小さく見つけてすべて取り切れるよう、一部を前もって取って調べるのが、がんの検査ですが、できればそれ全体を取って調べれば一番いい、という矛盾があります。
実際にはまず細胞単位で小さく採取する、小さな組織を採取する、大きな組織を採取する、全て切除して調べる、という風に少しずつ段階を上げて調べていきます。先の裁判のたとえで言えば、最初から決定的な大きな証拠があれば最初の裁判で判決が出るでしょうが、しっかりした証拠がなければ最高裁判所まで争われるイメージでしょうか。
したがって病理検査も1回ではなく、検査方法を変えたり、機会を改めたりして、何度か行われる必要が生じる可能性があるのです。
この写真では、病理の先生が、ここががんだよ、と赤いインクで囲ってくれています。それでもどうしてそこががんで、他のところは逆にがんでないのか、一般の方はわからないでしょう。
病理医は様々な学問や研究の結果を自分の経験に落とし込んで訓練を重ね、診断を付けますが、”だれがみてもすぐわかるものではない”ことは写真からもわかります。そもそも自分の細胞であるがん細胞を正常細胞と区別して、がんである、と診断することは非常に難しい作業なのです。
裁判で無罪の人を牢屋に入れてはいけません。病理診断も同じです。患者さんはそのことによって乳腺を切除されることになり得るのですから、良性のもので乳腺を手術することは、たとえ小さな切除であっても、可能な限り避けなければなりません。
■病理検査の“順序”
ここでは順序と言いましたが、順序通り行われるとは限りません。先に述べたように最初から決定的な証拠が出ることもあれば、最高裁まで行っても判決がつかずに争われることはあります。
病理検査を侵襲が小さい順に列記していきます。
1. 吸引細胞診 採血などに用いられる注射の針を使って、組織から細胞を吸いだして調べる検査です。ばらばらの細胞を採取できますが、その細胞が“浸潤”しているかどうかはわからないなど、情報量は限られます。下の写真のように、レゴのブロックに例えれば、たくさんのブロックをばらばらに集めてきて、これは何のブロックか?と尋ねるようなものです。

2. 針生検 絵のような特殊な形状をした針を使い、針の中の空隙に組織を小さく切り取って採取します。イメージとしては5㎜くらいのシャーペンの芯程度の組織が取れます。レゴのイメージからすれば、その一部を小さく採取して、全体を想像するようなものです。患者さんも負担からも、診断に至る可能性からも最もバランスが取れていますが、悪性度が低い比較的おとなしいがんなど、針生検でも診断がつきにくい場合もあります。

3. 吸引式組織生検 細いパイプ状の針をがんに突き刺し、そのパイプの中にがん組織を吸い込みます。吸い込んだうえで切り取って採取します。イメージとしては太さ2-3㎜長さ1㎝程度の鉛筆の芯程度の組織が採取できます。2と異なり、何度もさすことなく、写真のようにそのままいくつでも標本を採取できます。レゴの方も、大きいうえに数があれば、車のブロックなんだな、とすぐにわかりますね。

順を追って説明しました。
1の細胞診は、細胞のみで判断しなければならないため、がんかどうか、それのみの判断に用いられます。ただ現在この細胞診の結果だけで、手術まで施行する施設はほとんどなく、多くの手術を行う病院では2,あるいは3まで施行し、診断をより詳細に確定してから手術を行っています。つまりがんであれば2,あるいは3はいずれ手術前に必要になります。
2、3と段階を上げれば、採取される組織が大きくなるため、がんの診断は容易になり、さらにその確定診断後に様々な検査を加えることで、たとえばそのがんがどういう性格をもっているのか、ホルモン剤は効くのか、抗がん剤が必要になる可能性があるか、など、詳しい検査が手術前に可能になります。
ただその分、針も太くなり、出血もしやすくなり、保険がきいてもよりコストがかかるようになります。3の方法は使われる機器も高額で、手技もほぼ手術に準じるため、保険がきいても高額になります。その分、診断がもともと難しい病変であっても、手術から得られる標本とほぼ変わらない情報量を前もって得ることができると考えられています。
いずれの方法も、検査時間に差はなく、15分程度です。もちろん日帰りでできます。
ただしその日は原則として安静を守っていただき、激しい運動、そして出血しやすくなる理由で飲酒は避けていただきます。内出血して青くなっても心配は不要です。念のため、化膿止めの抗生剤、痛み止めを処方させていただきます。
コストを抑制するには、上から順を追って検査することが理想ですが、たとえば進行がんが予想され、治療を急ぐなど、3から検査をすることもあり得るでしょう。主治医と相談しながら決めていきましょう。
さらに興味のある方へ
現在2の検査方法と3の検査方法の優劣に関しては、3の検査が比較的新しいため、結論が出ていません。1、2、3の検査のいずれを施行したとしても、たとえば乳腺が非常に薄い、あるいは逆にひじょうに厚く、病変が深い、など、条件が悪ければ診断は難しくなります。針の進みのコントロールが難しくなるからです。いずれにせよ、しっかりと腫瘍の”いいところ”がとれれば、診断は確実につきます。
1と2に関しては、以前からある検査ですので、多くのデータが残されており、解析がなされています。下記にそれを示します。ただコスト面での違い、出血のしやすさ、診断までに要する期間、などそれだけで優劣がつけがたいことだけは繰り返し強調しておきます。
| 検査方法 | がんをがんと診断できる確率 | がんでないものを がんでないと診断できる確率 |
|---|---|---|
| 1 穿刺吸引細胞診 | 74%(95%CI 72‒77%) | 96%(95%CI 94‒98%) |
| 2 針生検 | 87%(95%CI 84‒88%) | 98%(95%CI 96‒99%) |
( )の中は95%の確率で、この範囲内に収まる、という意味になります。
この数値は、我々のものではなく、日本乳がん学会が医師用のガイドラインの中で提示している、たくさんの施設のデータを総合して出された数値です。
がんをがんと診断できる確率、が意外と低い、と感じられた方も多いかもしれません。だからこそ3の検査が存在し、また1や2で良性と診断されたとしても、画像上どうしてもがんが疑われた際には3を行うことがあり得る、ということなのです。
がんの診断は難しいのだな、とわかっていただければ幸いです。
2021.05.10
■線維腺腫の組織発生
線維腺腫は、細胞が異常な増殖を示すことによる病変ですが、顕微鏡で見ても正常の乳腺細胞となんら変わりはありません。がんでは、悪性の細胞が出現し、それが増殖して固まりを形成していますが、線維腺腫では正常な乳腺の一部分がただ“異常に腫れた”状態であることが分かっています。したがって自然な経過で消えることがあります。10~20歳代の女性に好発します。もちろん一人の方に両側にわたって数個存在することも珍しくありません。手術して摘出すると、下の写真のような固まりなので、腫瘍と思われていることが多いのですが違います。
■線維腺腫の自然経過
線維腺腫は基本的には2~3cmの大きさになると増殖が止まります。そして線維腺腫のほぼ半分は自然に消えていきます。
10~20歳代の女性が検診を受けると、線維腺腫はよく見つかります。もちろん悪性ではないので原則切除はされません。そして40~50歳代と年齢が進むにしたがって、線維腺腫をもった患者さんの数は減っていきます。線維腺腫は年齢とともに、自然に退縮して消えていくと考えられています。線維腺腫のこのような経過は、病変の本質が腫瘍ではなく過形成(ただ腫れているだけ)であるということを裏づけています。
■線維腺腫の診断
触診では、線維腺腫は周囲乳腺組織とはっきり異なり、コロコロとよく動く固まりとして触ります。
超音波検査では、境界が明瞭で、内部が均一な硬い塊として描出されます。多くは角のない楕円形ですが、写真のように凸凹があるものも珍しくありません。
マンモグラフィでは線維腺腫はよくわからないことがほとんどです。正常な乳腺細胞と差がほとんどないため、描出されないのです。一部で石灰化していたり、閉経後で乳腺が柔らかくなった方に珍しく線維腺腫が残っていることがあったりすれば見えることがあります。
針で腫瘍を穿刺し、細胞を採取して調べる細胞診では、もちろん悪性細胞は認められません。
手術で腫瘍を切除すれば確実に診断できますが、ほとんどでその必要はないでしょう。
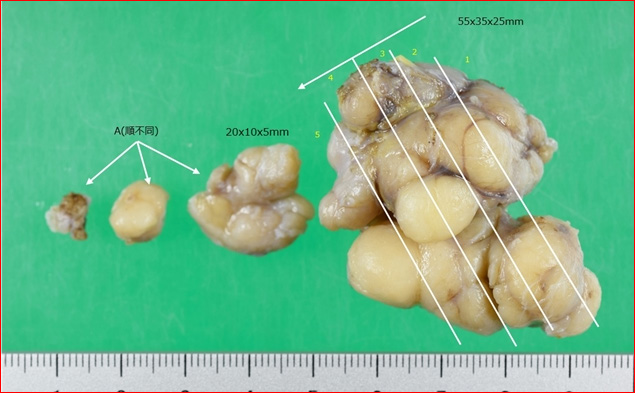
写真左は、切除されてすぐの状態の写真です。多くはこのように球形や楕円で、コリコリと硬いものです。表面や内部はつやのある白色です。
写真右は、ホルマリン固定されており、色が変わっています。一人の方から切除された多数の線維腺腫です。様々な形があり、形だけで良性悪性を診断することは難しいことがわかります。この方のように同側、あるいは両側の乳腺に多発することもよくあります。しょうがのようにごつごつしていますが、基本的に周囲組織に“浸潤”していくことはまれで、手術で容易に摘出できます。
線維腺腫はそれ自体が乳がんになることは稀です。ただそれが存在することで、あるいはその知識があることで、自分で乳腺を触っていて、しこりを見つけた患者さんが、「たぶんまた線維腺腫ができたのだろう」と思い込んでしまうことが恐ろしいのです。「オオカミが来た」のイソップ童話のようです。自己判断しないことが重要です。
10~20歳代の女性に発生している、線維腺腫では、専門の医師であれば触診だけでも高率に線維腺腫と診断することが可能です。ただそう診断したとしても、ほとんどの場合1回の診察で良しとせず、経過観察して変化のないことを確認していることがほとんどです。
ごくまれに線維腺腫によく似た触診所見を呈する乳がんも存在します。また線維腺腫が乳腺の細胞からできている以上、そこから乳がんが発生することもあり得ないとは言い切れません。たとえ年齢が10~20歳代であっても、それだけでよしとせず、専門の医師の判断によって、針で突いて細胞をとって調べる穿刺細胞診などの病理学的な検査で確定させる必要があることはあり得ます。
■線維腺腫の治療方針
医師によって線維腺腫と診断され、かつ腫瘤の大きさが3cm以下のときは通常、切除は不要で経過観察で問題ありません。大事なことはたとえ良性と診断されても定期的に検査を受けていくことです。
ここでは医師が線維腺腫と診断していても手術を検討しなければならない場合について述べます。
腫瘤が3cmを超える場合は、葉状腫瘍とよばれる線維腺腫とよく似た悪性疾患である可能性が高くなるので切除したほうがよいと思われます。また、腫瘤が3cm以下の場合でも、患者の年齢が40歳を超えると葉状腫瘍の可能性および乳がんを線維腺腫と誤診している可能性が無視できなくなるので、組織を一部で採取して診断確定させる、思い切って切除して診断確定させるほうがよいと思われます。
手術をし、腫瘤を摘出したら、穴が開いてしまうのですか?そこにへこみができますか?とよく聞かれますが、経験的にはよほど大きなものでない限り、摘出した傷は残っても、乳腺の変形はほとんどありません。クッションに落ちた文鎮を拾ったように、へこみは周囲の正常な部分が持ち上がって消えてしまいます。
逆にこれから述べる3つの条件を満たしていれば経過観察で十分です。(1)細胞診が陰性、(2)腫瘤径が3cm以下、(3)年齢が40歳以下、の場合は、経過観察(6~12ヵ月に1回)で十分です。
線維腺腫は妊娠にともなって増大することがありますが、妊娠の継続や授乳に影響を与えるほど大きくなることはまずありません。また通常、授乳が終われば乳腺の退縮にともなって腫瘤も自然に退縮することが多いので、妊娠時の腫瘤の増大は一般的には経過観察でよいと思われます。
■葉状腫瘍
線維腺腫と鑑別を要する疾患として葉状腫瘍があります。葉状腫瘍は、線維腺腫が良性の細胞の異常な増殖であるのと異なり、良性と悪性の中間の性質をもつ腫瘍です。線維腺腫が通常、2~3cmの大きさでその増殖が止まるのとは対照的に、葉状腫瘍はしばしば短期間で10cmを超える巨大な腫瘍に成長します。
悪性度が高い葉状腫瘍では、肺、骨などに遠隔転移することがあります。したがって葉状腫瘍は切除による治療の対象です。しかし小さい段階での葉状腫瘍は、線維腺腫と画像上も、検査所見上も、そして細胞や組織を採取して調べても、いろいろな意味でよく似ていて鑑別することは容易ではありません。
そのことからも線維腺腫と診断された腫瘍であっても、原則経過観察が必要になります。
そして3㎝を超えて増大してくるようであれば葉状腫瘍の可能性が高いと判断して最低でも針による組織診、あるいは切除を検討するという方針が一般的です。
続き(この記事は乳がん術後、とくにトリプルネガティブ乳がんについてある程度知識を持っておられる方を対象に書かれているため、一般の方には難解です。また知識がおありの方も、できれば姫路赤十字病院ホームページで私が書いたトリプルネガティブ乳がんの記事を読まれた後で読んでいただくことで理解が深まると思います。)
http://himeji.jrc.or.jp/category/diagnosis/nyusengeka/topics/20170912_1.html
ここまで免疫チェックポイント阻害剤(ICI)がトリプルネガティブ乳がん、それもPD-L1をがん細胞が提示していて、リンパ球の攻撃から逃れている可能性があれば、いままでの抗がん剤のみの治療と比較して、効果があることが証明されたことの話をしてきました。
再発、転移乳がんの治療は、しかし延命治療のニュアンスがあるため、皆さんの中には数か月余命が伸びたところでと思われる方が多いかもしれません。ただ、たとえば手術前後の治癒する可能性が高い患者さんに、こうした新薬を使って万が一でも今までの治療よりも結果が劣ることになれば、そのことはすなわち治癒するべき方を治癒できなくした、ということになります。順序として再発・転移の進行した乳がん患者さんで延命効果が証明された薬剤でなければ、手術前後の治癒を狙った治療には応用されにくいのです。
前置きが長くなりました。
こうしてICIは再発・転移乳がん患者さんの延命効果が証明されました。次は手術前後でこの薬剤を使用して、“治癒率”が上がるかどうかです。今までの治療では5割の方が治癒していた、それがICIを使用することによって6割、7割の方が治癒できるのか。その結果が2020年2月に発表されました。
https://www.nejm.org/doi/pdf/10.1056/NEJMoa1910549?articleTools=true
この試験 KEYNOTE-522では、ステージ2あるいは3の比較的進行したトリプルネガティブ乳がん患者さんをランダムに2:1に分け、従来の化学治療(この試験ではパクリタキセル+カルボプラチン → EC あるいはACです)にICIとしてキィトルーダを加えたもの、そしてプラセボを加えた群に分けました。
注意が必要なのは、この試験は手術前の抗がん剤(Neoadjuvant chemotherapyと言います)として行われ、その後に行われる手術でがん細胞が完全に死滅しているかどうか、その割合の高いのはどちらか、という観点で行われました。
手術前化学治療はほぼ半年間で行われます。手術はその後、時を置かずに施行され、摘出された標本はこれもすぐに病理検査されます。つまり半年あれば一人の方のデータが取れます。
術後 治癒したといえるにはトリプルネガティブ乳がんでは最低3年、通常5年間再発がないことが証明されなければならず、治癒した割合を比較する試験は結果が出るのが遅れてしまうのです(これも将来発表されることはわかっています)。
さてその結果です。
ICI投与群では64.8%の方のがんが消失していました。非投与群では51.2%であり、有意(p<0.001)に投与群で成績が良いことが証明されました。副作用は、先日のデータと変わらず、ICIに特徴的な皮膚の変化、そして甲状腺機能異常、副腎機能異常が認められましたが、投与を中止しなければならないレベルの副作用はまれでした。
この試験ではPD-L1の発現条件を加味せずにエントリーが行われたため、PD-L1の発現の強弱で効果が異なるかどうかは結論が出ませんが、発言が強ければ強いほど、効果が期待できることは簡単に予想できることでしょう。
ついに補助化学治療においても、ICIの効果が証明されました。つまり進行したトリプルネガティブ乳がんを治癒に導くことのできる可能性が、ICIによって今後高まることが示されたと言えます。
今まで乳がんは大きく4つに分けられていました。ルミナールA ルミナールB HER2エンリッチ、そしてトリプルネガティブ乳がんです。この分類がそのがん細胞のもつ標的と、その治療によって分けられていたことは皆さんもご存知の通りです。下の図を見てください。
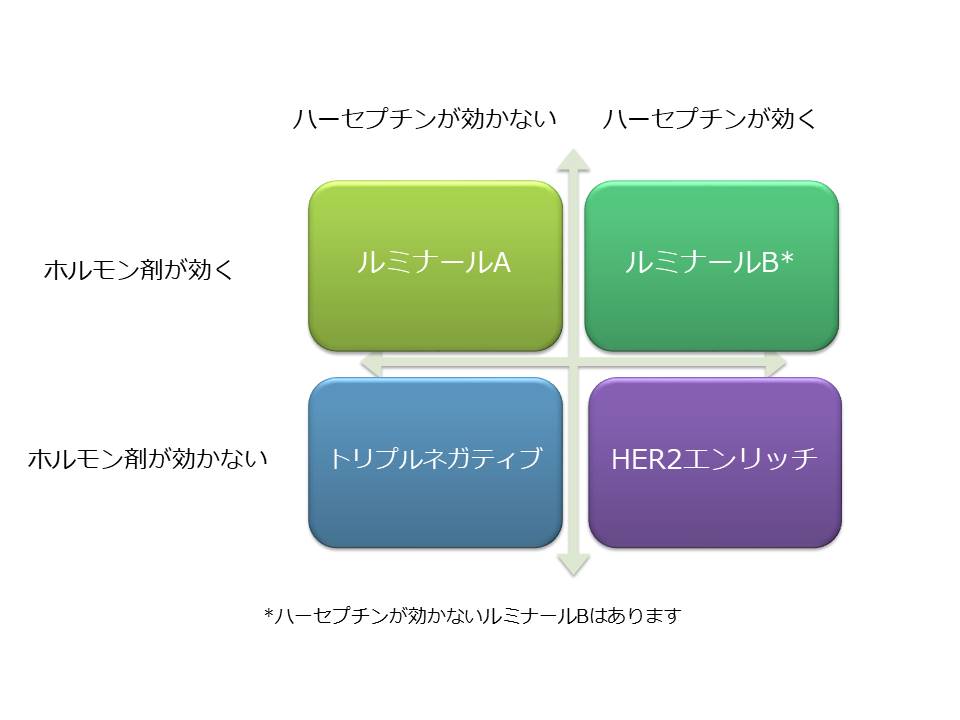
ルミナールBタイプは発言の強弱があってグレーゾーンであり、この4つは実際にはこれほど厳密には分けられない部分もあります。しかしトリプルネガティブ乳がんに関しては、両方とも発現が0であるガン細胞として特徴的です。ホルモン剤も、そしてハーセプチンをはじめとするHER2への標的薬剤も効果が期待できず、抗がん剤に関しても使用してみないと効果はわからないのが原則でした。
しかし以前 姫路赤十字病院のホームページでお話ししたPARP阻害剤(現在リムパーザ®が保険適応になっています)に関しての効く、効かない、そしてそれに加えてICIの効く、効かない、が加わったため、これからはトリプルネガティブ乳がんも4つに分けられることが明らかです。(下の図を参照してください)
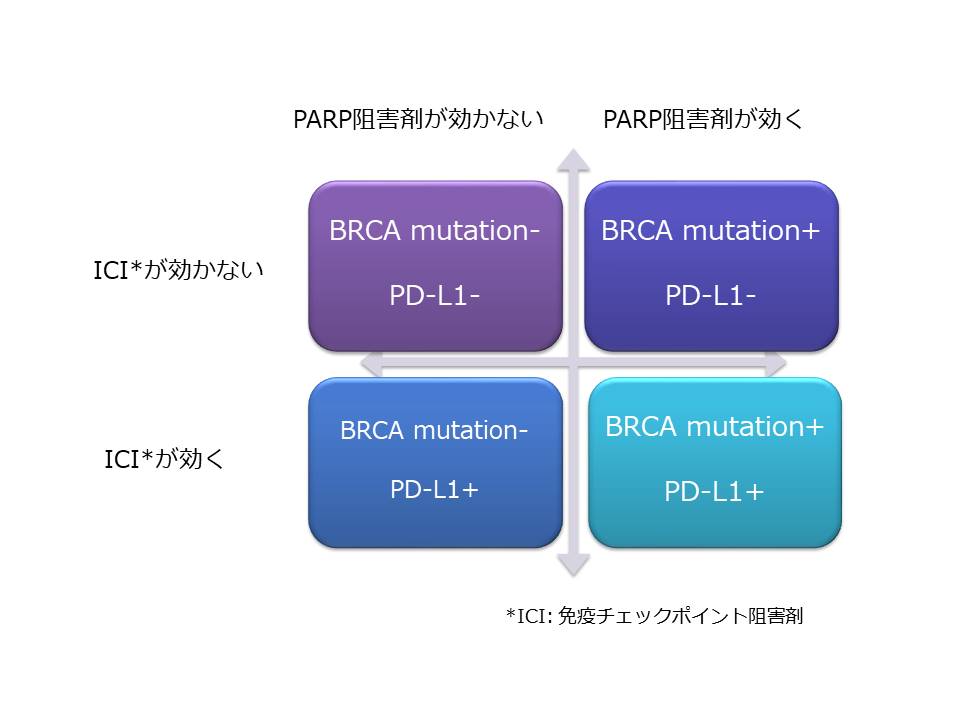
以前書いた6つの分類とは異なる分類ですが、おそらくBRCA mutation+ PD-L1-はBasal like 1タイプのトリプルネガティブ乳がんに、BRCA mutation- PD-L1+はIMタイプのトリプルネガティブ乳がんに相当すると考えられます。そして以前お話ししたとおり、トリプルネガティブ乳がんの6つの分類は、研究室のみで可能な話でしたし、現状はその域を出ていませんが、この4つの分類は今の日本の保険適応の検査でも分類可能です。つまりもはや実践段階なのです。
BRCA mutation- PD-L1-のトリプルネガティブ乳がんのなかのトリプルネガティブ乳がんについても、もちろん研究と治療の開発が進んでいます。6つの分類のうちに薬が揃っていないPI3K阻害剤はすでにたくさんの薬が開発済みで試験が始まっています。
憎きトリプルネガティブ乳がんの包囲網は狭まりつつある、そういえるようになってきています。皆さんの治療に役立つ段階なのです。始まりの終わり、黎明期は終わりました。つかみどころのないトリプルネガティブ乳がん、のイメージは変わりつつあります。これからは実践投入の中でさまざまな喜びと、そして学びの中から更なる課題が出てくるでしょう。
以前 私が勤務していた姫路赤十字病院のホームページでは、乳がんに関していくつか記事を書かせていただいていました。幸いご好評いただき、たくさんのアクセスを頂いた記事もあります。その中でTriple negative(トリプルネガティブ)乳がんの記事は飛びぬけてアクセス数が伸びており、関心の高さを感じさせていただいたとともに、このがんで苦しんでおられる患者さんの多いこともまた実感として感じていました(http://himeji.jrc.or.jp/category/diagnosis/nyusengeka/topics/20170912_3.html)。
その記事の中で“トリプルネガティブ乳がんは一種類ではない”ということを述べました。大きく6つに分けられており、それぞれに対応する治療法もまた開発が進んでいると述べました。6種類のタイプ分けはがんの遺伝子の解析から導き出されたものであり、研究段階であるため、いま病院で治療中の方にはまだまだ応用できるもの、できないものがあります。2021年現在、DNAプロファイリングと呼ばれる手法が、実地臨床にも導入されつつありますが、それでもそれによってきれいに6つに分類できるものではなく、もちろん対応するとされる治療法もそのタイプであれば必ず効いたり、それ以外のタイプには全く効かなかったりするものではありません。トリプルネガティブ乳がんという、特徴のないことが特徴のがんに対して、すこしでも特徴を見つけ、タイプ分けできれば理解が進み、治療の標的を決めやすくなることから、仮にそのように分類された、と考えておいた方がよいでしょう。
さてその記事の中で、IMとされた分類、別名 髄様がん(Medullary breast cancer)について述べました。この種類のトリプルネガティブ乳がんの腫瘍部分を顕微鏡で観察すると、腫瘍浸潤リンパ球(TIL)と呼ばれるがんをやっつけようと集まってくるリンパ球がたくさん観察されます。私たちの体に備わっている免疫細胞が戦ってくれているので、もともとトリプルネガティブ乳がんの中では予後が良いことが知られていました。
ただがんとして、しっかり成立しているのだから、このがん細胞はこうして集まってきているリンパ球を無力化する力を持っていることもわかります。まして転移再発を来してどんどん病状が進んでいればなおさらです。
最近、この働きをつかさどるPD-1、PD-L1と呼ばれるシステムが見つかりました。京都大学特別教授の本庶佑先生が発見したたこの免疫の監視から“逃げる”機能の発見は、のちに様々な方法で“逃がさない”方法を開発することにつながり、がんの治療、特に肺がんの治療方法を画期的、かつ完全に書き換えてしまいました。この功績によって本庶先生は2018年のノーベル賞を受賞されています。

このシステムをわかりやすく描くと上の図のようになります。がん細胞をやっつけようと集まってきたリンパ球に、がん細胞はPD-L1を使って賄賂を渡し、お目こぼしを図る。リンパ球がPD-1でそれを受け取ってしまうと、集まってきても何もしなくなり、攻撃をやめてしまうのです。この賄賂のやり取りの現場は免疫チェックポイントと呼ばれています。免疫チェックポイント阻害剤(ICI)と呼ばれる薬剤はこの現場をブロックしてしまいます。これによってがん細胞をやっつけに来た免疫細胞が本来の役割を取り戻し、攻撃を始めます。これにより、抗がん剤に強い抵抗性を持つがん細胞を破壊することが可能になり、いままで難治とされたがんの治療にも大きな成果が上がっています。
乳がんもその例にもれず、少しずつこのICIが効果を上げるものが見つかってきました。
その一つが先に述べたトリプルネガティブ乳がん、髄様がんであり、またその分類に属さないタイプの乳がんであっても、そのがん細胞が細胞表面にPD-L1を多く表出しているものではICIが効果を発揮することがわかってきました。
2020年米国臨床腫瘍学会(ASCO)で発表され、12月にLansetで論文発表されたKEYNOTE-355は転移性のトリプルネガティブ乳がんに対するICIの効果を証明したものとして大きな話題になりました。(https://www.thelancet.com/action/showPdf?pii=S0140-6736%2820%2932531-9)
この試験ではPembrolizumab(日本名 キイトルーダ)というICIを使用します。
再発・転移を抱えるトリプルネガティブ乳がん患者さんを治療するにあたって、医師が選んだ抗がん剤のみ(プラセボを上乗せ)で治療する群と、抗がん剤に加えてキイトルーダを上乗せする群に分けて、効果(どれくらいの期間進行を抑えることができるのか?)、そして副作用の内容や出現率を比較しました。
まず、PD-L1を強く表出している群、そして弱いけれどもわずかでも表出している群、そしてしていない群に分けます。その上でそれぞれの群をランダムにキイトルーダを使用する群と使用しない群に振り分けたのです。ここでは髄様がんかどうかではありません。がん細胞がPD-L1を出しているかどうか、が問題でした。
下のグラフは、強くPD-L1を表出していたトリプルネガティブ乳がんに対するキイトルーダの上乗せ効果を示した結果です。
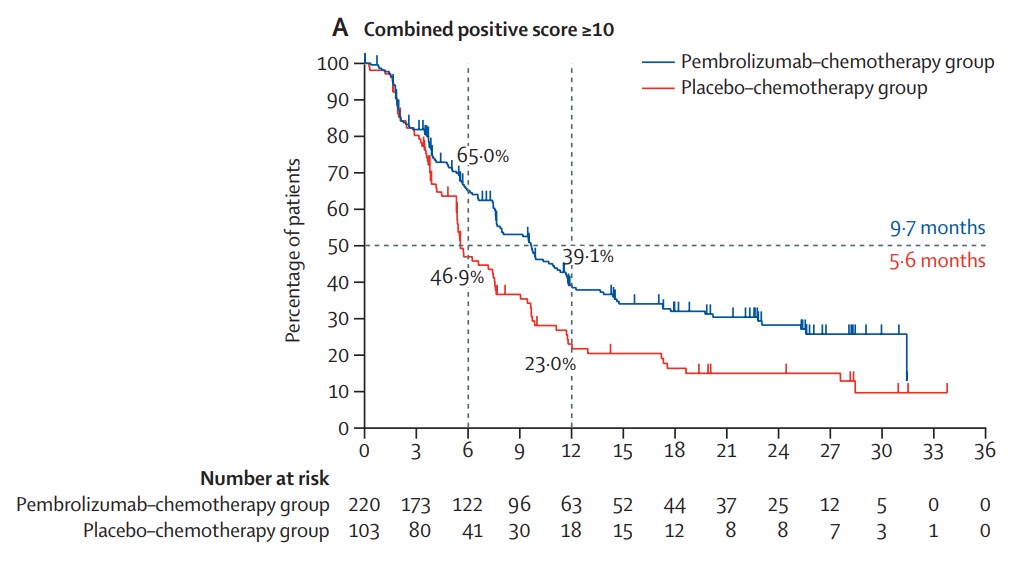
このグラフの見方は、50%の患者さんで進行を4.1か月遅らせることに成功した、と読みます。青色の線は常に赤の上にあり、治療期間全体にわたって、キイトルーダを併用した群はしなかった群よりもがんの進行が抑制されました。
治るのではないのか、たかが4か月なのか、とわずかな効果に見えるかもしれませんが、キイトルーダなしで化学治療を行った場合、つまり今まで通りの治療であれば、50%の方は5.6か月で再び進行が始まることが示されています。キイトルーダはそれを9.7か月と倍に伸ばしたことになります。その計算倍率からすれば、今までの治療で1年間有効であった方はそれが2年に延びます。素晴らしい結果だったのです。
一方で副作用はどうでしょう。いままでさまざまな“サプリメント”が“免疫を改善する”、”免疫を増強する”と歌って発売されました。先日もある患者さんと、そういえば水素水も免疫がどうしたこうしたと言われていましたね、と話をしました。免疫の難しいところは、上がったにせよ、下がったにせよ、その機能を測定できない、ところにあります。たしかに白血球が少なくなれば免疫が落ちている可能性がありますが、それも免疫がまったく正常の方でもなんらかの感染がなければ低い数値になっていることはよくあります。逆に感染症を起こして高熱にうなされ、重症になっていれば白血球は上昇していますが、そもそも感染を起こしているのですから、免疫がしっかり働いて、などと感じないはずです。
副作用から見たとき、このICIの恐ろしいところは、がん細胞が免疫から逃げるために使っているPD-L1という分子は、正常細胞も必要な時に使う大切な機能のひとつである、そこを阻害してしまう、ということです。つまりICIが働けば、免疫細胞はがん細胞の攻撃を始めるだけではなく、それを使って免疫から攻撃されないようにしている正常な細胞も攻撃を始めるのです。
キイトルーダを使用したこの試験でのその代表が甲状腺機能低下、あるいは亢進です。橋本病(甲状腺機能低下)、バセドウ病(甲状腺機能亢進)はいずれも免疫の異常によって引き起こされます。これがICIによって引き起こされるのです。それ以外にも、ICIには抗がん剤では見られない特徴的な副作用があることがわかってきています。アトピーに似た皮膚の炎症はよく見られる合併症です。副腎機能異常、心筋炎といった重篤な副作用も報告されています。
ICIを使って治療を行っている医師の間では、免疫のお薬だから、効果は高く、副作用は軽い、だから抗がん剤よりも気楽に使える、と考えるのは早計だということがもうわかっています。ただいままで抗がん剤で治療してきても効果が今一つ得られなかったがん患者さんには、選択肢が確実に増え、朗報であることは間違いありません。
長くなりましたので、次回と2回に分けて、トリプルネガティブ乳がんと免疫チェックポイント阻害剤について、さらに解説していきます。
ご予約専用ダイヤル
079-283-6103